Реферат: Энергия активации
ехр[-Еа(Т2 – T1 )/RT1 T2 ] = τ2 / τ1 .(13)
Следовательно, при заданных T1 и Т2 отношение τ2 / τ1 для реакций, протекающих на одну и ту же глубину, постоянно и называется коэффициентом трансформации. Если этот коэффициент известен, то значение энергии активации рассчитывается по формуле:
Еа = R[T1 T2 /(Т2 – T1 )]-ln(τ2 / τ1 ).(14)
Реакция иодирования ацетона
Вкачестве объекта исследования в данной работе выбрана реакция иодирования ацетона. Реакция
СНзСОСНз + I 2 = СНзСОС H 2 I + HI (15)
катализируется кислотами Бренстеда(донорами протонов). Эта реакция катализируется сильной минеральной кислотой.
Как видно из уравнения, один из продуктов реакции - иодоводородная кислота (катализатор). Поэтому концентрация катализатора в ходе опыта возрастает. Такие процессы называются автокаталитическими.
Можно выделить две стадии реакции. На первой происходит таутомерное превращение кетона в енол, катализатор - ионы оксония:
СНзСОСНз—> СНзС(ОН)=СН2 ; К1 (16)
Затем (вторая стадия ) енол реагирует с иодом:
СНзС ( ОН )= СН 2 + I2 = CH3 COCH2 I + HI; К 2 (17)
Вторая стадия очень быстрая, а первая - скорость лимитирующая. Поэтому скорость реакции равна скорости енолизации ацетона:
dc/dτ = К1 Са сH O (18)
где Са - концентрация ацетона;
С H 3 O + - концентрация ионов оксония (ионов водорода). От концентрации иода скорость реакции не зависит. Обозначим через а и b - числа моль ацетона и оксоний-ионов в начальный
момент времени в колбе объемом V; х - количество прореагировавших ацетона и иода,
равное количеству вновь образовавшихся оксоний-ионов.
Тогда:
Са = (a-x)/V; С H 3 O + = ( b+x)/V.(l 9)
Подставляя (19) в (18), находим:
dx/dτ = (K1 /V)(a-x)(b+x).
После интегрирования этогоуравнения в пределах от х=0 до х и от τ=0 до х, разрешения относительно K1 получим выражение:
K1 = V/(a+b) τ*In a(b+x)/(a-x)b, (20)
в котором числа моль а и b - заданыусловиями приготовления рабочей смеси, а х в зависимости от τопределяют путем титрования иода тиосульфатом натрия.
Если перейти к концентрациям веществ, участвующих в реакции, то уравнение (20) приобретет вид:
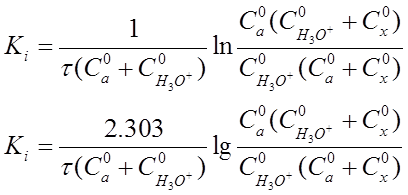 (21)
(21)
где С°а - начальная концентрация ацетона, моль-экв/л;
С H 3 O + - начальная концентрация ионов оксония (ионов водорода), моль-экв/л;