Реферат: Исследование денатурации белка под действием ионных детергентов
Московский государственный университет им. М.В. Ломоносова
физический факультет кафедра общей физики
ДОКЛАД
На тему:
«Денатурация белков под действием ионных детергентов»
Выполнила студентка группы 505
Даренская Татьяна Владимировна
Москва – 2010
Оглавление
1. Белки и их структура.3
2. Денатурация белков. 6
3. Детергенты.. 8
4. Денатурация под действием ионных детергентов. 11
1. Белки и их структуры.
Белки - полимерные молекулы, в которых мономерами служат аминокислоты. Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, соединённых прочными пептидными связями. За счёт внутримолекулярных взаимодействий белки образуют определённую пространственную структуру, называемую "конформация белков". Линейная последовательность аминокислот в белке содержит информацию о построении трёхмерной пространственной структуры. Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами (рис. 1.1). Существуют общие правила, по которым идёт формирование пространственных структур белков.

Рис. 1.1 - Этапы формирования конформации белков. 1 - первичная структура; 2 - вторичная структура; 3 - третичная структура; 4 - четвертичная структура.
Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определённом порядке. Линейную последовательность аминокислотных остатков в полипептидной цепи называют "первичная структура белка".
Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру. Все молекулы данного индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что в первую очередь отличает данный индивидуальный белок от любого другого.
Линейные полипептидные цепи индивидуальных белков за счёт взаимодействия функциональных групп аминокислот приобретают определённую пространственную трёхмерную структуру, называемую "конформация". Все молекулы индивидуальных белков (т.е. имеющих одинаковую первичную структуру) образуют в растворе одинаковую конформацию. Следовательно, вся информация, необходимая для формирования пространственных структур, находится в первичной структуре белков.
В белках различают 2 основных типа конформации полипептидных цепей: вторичную и третичную структуры.
Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спираль и β-структура.
 В α-спирали пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1.2). На один виток α-спирали приходится 3,6 аминокислотных остатка.
В α-спирали пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1.2). На один виток α-спирали приходится 3,6 аминокислотных остатка.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате α-спираль "стягивается" множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность α-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) α-спиралей уменьшается, а их гидрофобность увеличивается.
 β -Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями, β-Структура образует фигуру, подобную листу, сложенному "гармошкой", - β-складчатый слой (рис. 1.3).
β -Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями, β-Структура образует фигуру, подобную листу, сложенному "гармошкой", - β-складчатый слой (рис. 1.3).
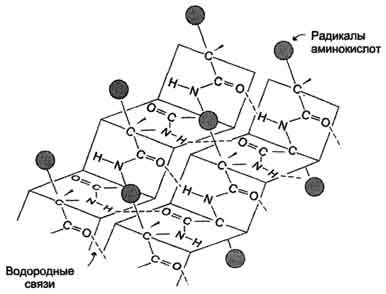
Рис. 1.3 - Вторичная структура белков в виде β-складчатого слоя.
Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В b-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия,а также силы ван дер Ваальса между близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка.
Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей.
Ионные связимогут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными). Водородные связивозникают между гидрофильными незаряженными группами (такими как -ОН, -CONH2 , SH-группы) и любыми другими гидрофильными группами. Белки, функционирующие в неполярном (липидном) окружении, например белки мембран, имеют обратное устройство: гидрофильные радикалы аминокислот расположены внутри белка, в то время как гидрофобные аминокислоты локализованы на поверхности молекулы и контактируют с неполярным окружением. В каждом случае радикалы аминокислот занимают наиболее выгодное биоэнергетическое положение.
Третичную структуру некоторых белков стабилизируют дисульфидные связи,образующиеся за счёт взаимодействия SH-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов.
Большинство внутриклеточных белков лишено дисульфидных связей. Однако такие связи распространены в белках, секретируемых клеткой во внеклеточное пространство. Полагают, что эти ковалентные связи стабилизируют кон-формацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гормон инсулин и иммуноглобулины.
Все белки с одинаковой первичной структурой, находящиеся в одинаковых условиях, приобретают одинаковую, характерную для данного индивидуального белка конформацию, определяющую его специфическую функцию. Функционально активную конформацию белка называют "нативная структура".
Если полипептидная цепь белка содержит более 200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. Домен- участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи кон-формацию глобулярного белка. Так, лёгкая цепь иммуноглобулина G состоит из двух доменов. В некоторых случаях доменами называют отдельные структурные участки полипептидной цепи.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--