Реферат: Исследование денатурации белка под действием ионных детергентов
Многие белки содержат в своём составе только одну полипептидную цепь. Такие белки называют мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок).
В то же время существуют белки, состоящие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединяются с помощью тех же слабых взаимодействий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных.
Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков".Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным. В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки).
Белки играют центральную роль в реализации и регуляции практически всех процессов жизнедеятельности, протекающих в организмах на молекулярном уровне, поэтому проблема взаимосвязи структуры и функции белковых макромолекул является одной из центральных в современной науке. Для того чтобы белки эффективно осуществляли свои функции, необходима определенная стабильность белковой макромолекулы. Белковые макромолекулы способны претерпевать структурные перестройки под действием различных агентов.
2. Денатурация белков
Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её нативной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформации сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается.
В денатурированном белке гидрофобные радикалы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка.
Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами. Термическая обработка мясной пищи перед употреблением не только улучшает её вкусовые качества, но и облегчает её ферментативное переваривание в пищеварительной системе. Кроме того, денатурирующим действием на пищевые белки обладает и кислая среда желудка, вызывающая денатурацию тех белков, которые не подвергались предварительной температурной обработке, а также оказывает денатурирующее действие на белки микроорганизмов, попавших в желудок с пищей.
Денатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
- высокая температура (более 50 °С), увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей;
- интенсивное встряхивание раствора, приводящее к соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и изменению конформации этих молекул;
- органические вещества (например, этиловый спирт, фенол и его производные) способны взаимодействовать с функциональными группами белков, что приводит к их конформационным изменениям. Для денатурации белков в биохимических исследованиях часто используют мочевину или гуанидинхлорид, которые образуют водородные связи с амино- и карбонильными группами пептидного остова и некоторыми функциональными группами радикалов аминокислот. Происходит разрыв связей, участвующих в формировании вторичной и третичной структуры нативных белков, и образование новых связей с химическими реагентами;
- кислоты и щелочи, изменяя рН среды, вызывают перераспределение связей в молекуле белка;
- соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.) образуют прочные связи с важными функциональными группами белков (чаще всего с -SH), изменяя их конформацию и активность;
- детергенты - вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными).
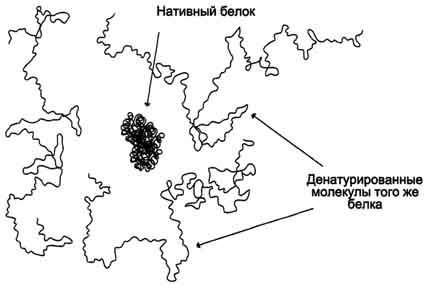
Рис. 2.1 - Структура нативной молекулы белка (в центре) и трёх денатурированных молекул этого же белка.
3. Детергенты
Детергенты (от лат. detergere — мыть, очищать) представляют собой поверхностно-активные вещества с моющим действием, которое обусловлено их способностью образовывать в воде устойчивые коллоидные растворы. Поверхностная активность детергентов, то есть способность адсорбироваться на границе раздела фаз (типа вода—воздух или вода—масло), связана с амфифильностью их молекул. Амфифильными (от греч. фило — любящий и амфи — обоих) называют вещества, в молекулах которых имеются четко разграниченные гидрофильные и гидрофобные области, благодаря чему такие молекулы обладают сродством не только по отношению к воде, но и к неполярным органическим растворителям.
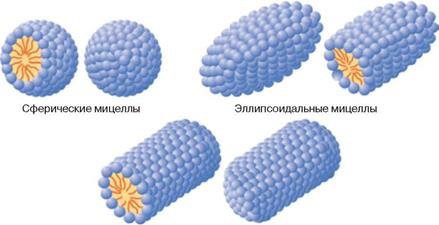
В воде молекулы детергентов стремятся ассоциировать друг с другом, давая мицеллы (рис. 3.1). Эти агрегаты состоят из большого числа детергентных молекул (обычно от нескольких десятков до нескольких сот), ориентированных в мицелле таким образом, что их неполярные группы формируют внутреннее гидрофобное ядро мицеллы, а гидрофильные полярные группировки находятся на ее поверхности и контактируют с окружающими молекулами воды.
![]()

Именно благодаря наличию гидрофобного ядра мицеллы способны солюбилизировать, то есть переводить в раствор неполярные вещества, практически нерастворимые в воде. В качестве параметров, характеризующих способность детергентов к мицеллообразованию, обычно используют критическую концентрацию мицеллообразования (ККМ) и число агрегации. ККМ — это та концентрация, при которой детергент начинает образовывать мицеллы. До этого он находится в воде в мономерной форме в состоянии истинного раствора. Число агрегации показывает, сколько молекул детергента приходится на одну мицеллу.
В настоящее время известно несколько сот различных детергентов. Все они разделяются на два основных класса: ионные и неионные детергенты в зависимости от наличия или отсутствия заряженных групп в гидрофильной области их молекул.
Неионогенные ПАВ растворяются в воде, не ионизируясь. Растворимость неионогенных ПАВ в воде обуславливается наличием в них функциональных групп. Как правило, они образуют клатраты в водном растворе вследствие возникновения водородных связей между молекулами воды и атомами кислорода полиэтиленгликолевой части молекулы ПАВ. К ним относятся: полигликолевые эфиры жирных спиртов и кислот, полигликолевые эфиры амидов жирных кислот, ацилированные или алкилированные поли гликолевые эфиры алкиламидов. Ярким представителем неионогенных ПАВ является Тритон Х-100 . Добавление этого сурфактанта в раствор зачастую улучшает растворимость белка, при этом не вызывая его денатурацию.
Основную долю в фармацевтических, косметических, медицинских и биохимических исследованиях составляют ионные детергенты, с их помощью влияют на энергетическое состояние и структуру межфазной поверхности и через неё регулируют свойства микрогетерогенных систем.
Благодаря высокой поверхностной активности и способности к растворению белков и липидов, а также способности вызывать диссоциацию и денатурацию белков, инактивацию вирусов и токсинов именно ионные детергенты широко применяются для приготовления медицинских фармацевтических препаратов (например, бактерицидных и дезинфицирующих), а также дерматологических и косметических средств.
Ионные детергенты по типу заряда делятся на катионные, анионные, и цвиттерионные (амфотерные).

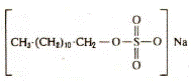 Анионные ПАВ - это соединения, которые в водных растворах диссоциируют с образованием анионов, обусловливающих поверхностную активность. Среди них наибольшее значение имеют линейный алкилбензосульфонат, сульфаты и сульфоэфиры жирных кислот. Широко используемым примером является детергент, додецилсульфат натрия (рис. 3.2).
Анионные ПАВ - это соединения, которые в водных растворах диссоциируют с образованием анионов, обусловливающих поверхностную активность. Среди них наибольшее значение имеют линейный алкилбензосульфонат, сульфаты и сульфоэфиры жирных кислот. Широко используемым примером является детергент, додецилсульфат натрия (рис. 3.2).

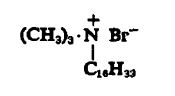 Катионные ПАВ в водном растворе диссоциируют с образованием катионов, определяющих поверхностную активность. Среди катионных ПАВ наибольшее значение имеют четвертичные аммониевые соединения, имидазалины и жирные амины. Одним из ярких представителей катионных детергентов является цетавлон (ЦТАБ) (рис. 3.3).
Катионные ПАВ в водном растворе диссоциируют с образованием катионов, определяющих поверхностную активность. Среди катионных ПАВ наибольшее значение имеют четвертичные аммониевые соединения, имидазалины и жирные амины. Одним из ярких представителей катионных детергентов является цетавлон (ЦТАБ) (рис. 3.3).
Д етергенты изменяют конформацию белка, в связи с этим исследование взаимодействия ПАВ, как ДСН и ЦТАБ, является важной задачей.
4. Денатурация под действием ионных детергентов
Гидрофобные радикалы белков взаимодействуют с гидрофобными частями детергентов, что изменяет конформацию белков. Денатурированный под действием детергентов белок обычно остаётся в растворённом виде, так как гидрофильные части денатурирующего вещества удерживают его в растворе. К наиболее известным детергентам относят различные мыла (рис. 4.1).
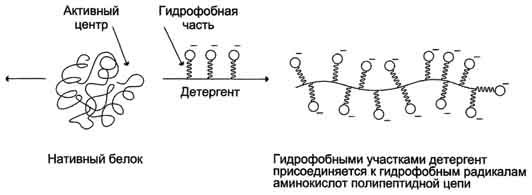
Рис. 4.1 - Денатурация белков с помощью детергентов.
Эффективными денатурирующими агентами являются ионные детергенты, среди которых в биохимической практике особенно часто используют анионный детергент додецилсульфат натрия (ДСН) и катионный детергент цетилтриметиламмонийбромид (ЦТАБ, цетавлон).
Взаимодействие белков с детергентами может изучаться различными методами: дифференциальной сканирующей калориметрией (DSC), с помощью кругового дихроизма, флуоресценции и УФ-спектроскопии поглощения.
Рассмотрим на примереисследования денатурации сывороточного альбумина человека (САЧ) под действием ионных детергентов по анализу собственной триптофановой флуоресценции белка.
На рис. 4.2 изображены зависимости интенсивности в максимуме спектров триптофановой флуоресценции сывороточного альбумина человека от концентрации ДСН для различных значений pH. Видно, что в растворах с ДСН триптофановая флуоресценция сывороточного альбумина человека тушится. Тушение триптофановой флуоресценции белка в растворах с ДСН объясняется его денатурацией, вследствие которой при разворачивании белковых глобул хромофорная группа триптофана альбумина становится более доступной для молекул воды, тушащих её свечение.
Из рис. 4.2 видно, что более сильное тушение собственной триптофановой флуоресценции сывороточного альбумина, наблюдаемое в растворах с ДСН, при одинаковых концентрациях ДСН имеет место при более низких значениях pH. Данная закономерность говорит об электростатическом механизме взаимодействия сывороточного альбумина человека с ДСН. ДСН в растворе диссоциирует на положительно заряженные катионы натрия и додецилсульфат-анионы, которые и взаимодействуют с белком. Молекулы сывороточного альбумина человека в целом заряжены положительно при pH, меньших pI альбумина.
Поэтому при низких значениях pH происходит интенсивное связывание в целом положительно заряженных макромолекул белка с додецилсульфат-анионами, вследствие чего происходит сильное тушение триптофановой флуоресценции альбумина. По мере увеличения pH в целом положительный заряд макромолекулы альбумина уменьшается, а при pH, больших pI, макромолекулы альбумина приобретают в целом отрицательный заряд. Поэтому при высоких значениях pH (больших pI) происходит слабое связывание додецилсульфат-анионов и в целом отрицательно заряженных молекул альбумина, хотя еще и сохраняющих какие-то положительно заряженные участки на своих поверхностях, вследствие чего в растворах с ДСН происходит слабое тушение триптофановой флуоресценции альбумина. Следовательно, более сильная денатурация белка под действием ДСН имеет место при pH, меньших pI белка.
Установленные из экспериментальных данных зависимости интенсивности в максимуме спектра триптофановой флуоресценции сывороточного альбумина человека при различных значениях pH от концентрации ДСН (рис. 4.2) можно объяснить двустадийным механизмом денатурации этого белка в присутствии ДСН. первая переходная стадия денатурации белка – разрыхление белковых глобул, вторая стадия денатурации – разворачивание аминокислотной цепи белка.