Реферат: Исследование денатурации белка под действием ионных детергентов
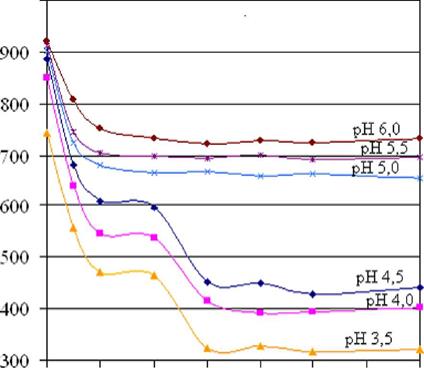
Дальнейшее увеличение (больше 1 мМ) концентрации ДСН при pH, больших изоэлектрической точки альбумина (pI 4,7) имеет практически постоянные значения интенсивности в максимуме спектра триптофановой флуоресценции, , следовательно, денатурация останавливается на первой стадии.
Иной характер зависимостей от концентрации ДСН наблюдается при pH, меньших pI белка в области концентраций ДСН от 1 мМ до 2 мМ интенсивность в максимуме спектра триптофановой флуоресценции имеет практически постоянные значения. При этих концентрациях ДСН (до 2 мМ) происходит первая переходная стадия денатурации белка: белковые глобулы разрыхляются, но полного разворачивания еще не произошло. При дальнейшем увеличении концентрации ДСН до 3 мМ происходит дальнейшее тушение триптофановой флуоресценции альбумина, что говорит о том, что белковые молекулы из переходного состояния разрыхленности переходят во вторую стадию денатурации - стадию полного разворачивания. При увеличении концентрации ДСН свыше 3 мМ (до 7 мМ) более сильного тушения триптофановой флуоресценции альбумина не происходит, что указывает на полную денатурацию молекул альбумина. Следовательно, подобное двухэтапное тушение собственной флуоресценции белка при увеличении концентрации ДСН при этих значениях pH, меньших pI белка, объясняется двустадийным механизмом его денатурации и последовательными конформационными перестройками белковой глобулы, приводящими к оголению триптофана и увеличению его доступности для молекул воды, тушащих его флуоресценцию.
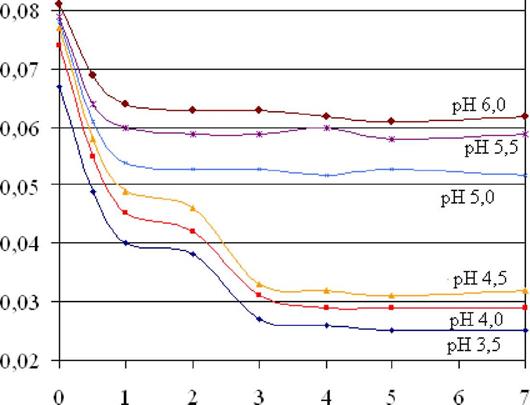
На рис. 4.3. изображена зависимость квантового выхода триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ДСН при различных значениях рН растворов. Из этой зависимости следуют аналогичные выводы о денатурации САЧ под действием ДСН.
| ||
| ||
|
Рис. 4.2 - Зависимость интенсивности в максимуме спектра триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ДСН при различных значениях рН растворов
|
|
Рис. 4.3 - Зависимости квантового выхода триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ДСН при различных значениях рН растворов
На рис. 4.4 изображены зависимости квантового выхода триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ЦТАБ при рН, больших pI белка.
Видно, что в растворах с ЦТАБ триптофановая флуоресценция сывороточного альбумина человека тушится. Тушение триптофановой флуоресценции белка в растворах с ЦТАБ объясняется его денатурацией, вследствие которой при разворачивании белковых глобул хромофорная группа триптофана альбумина становится более доступной для молекул воды, тушащих её свечение.
Из рис. 4.4 видно, что более сильное тушение собственной триптофановой флуоресценции сывороточного альбумина, наблюдаемое при одинаковых концентрациях ЦТАБ имеет место при более высоких значениях pH. Данная закономерность говорит об электростатическом механизме взаимодействия сывороточного альбумина человека с ЦТАБ. ЦТАБ в растворе диссоциирует на отрицательно заряженные анионы брома и цетилтриметиламмоний-катионы, которые и взаимодействуют с белком.
При высоких значениях pH (больших изоэлектрической точки белка) макромолекулы белка в целом заряжены отрицательно, поэтому происходит сильное связывание цетилтриметиламмоний-катионов с молекулами белка, флуоресценция белка в растворах ЦТАБ тушится сильно. По мере уменьшения pH отрицательный заряд молекулы альбумина уменьшается, связывание происходит более слабо, поэтому и квантовый выход флуоресценции альбумина в растворах ЦТАБ уменьшается слабее.
При дальнейшем уменьшении pH, при значениях рН, меньших изоэлектрической точки, макромолекулы белка становятся заряжены в целом положительно, но при этом сохраняются и отрицательно заряженные участки. В связи с этим происходит слабое связывание САЧ с катионами ЦТАБ и триптофановая флуоресценция альбумина тушится слабо в растворах с ЦТАБ по сравнению с растворами, не содержащими ЦТАБ.
Видно, что денатурация альбумина под действием ЦТАБ носит одностадийный характер при всех значениях рН.
Процесс денатурации под действием обоих детергентов носит электростатический характер, в связи с этим, характер процессов денатурации белка отличается в зависимости от значений рН.
Было получено, что денатурация альбумина под действием ДСН носит двустадийный характер (первая стадия - разрыхление глобул, вторая - полное разворачивание аминокислотной цепи белка), а под действием ЦТАБ - одностадийный.
Аналогичные результаты были получены и с помощью других методов исследования.
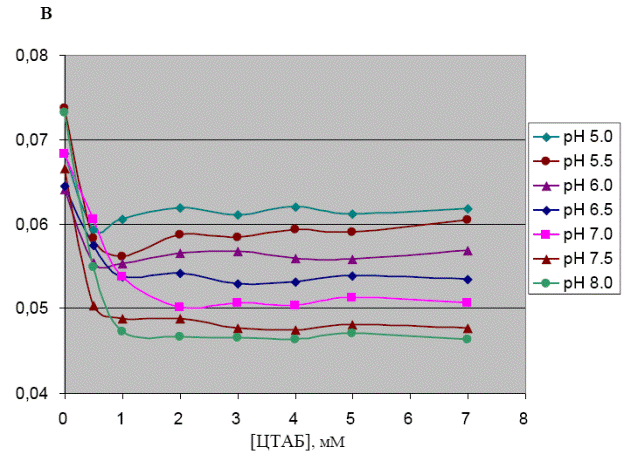
Рис. 4.4 - Зависимости квантового выхода триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ЦТАБ при рН, больших pI белка.