Реферат: Изучение трехмерной структуры с помощью рентгеновской дифракции и реконструкции изображения
Изучение трехмерной структуры с помощью рентгеновской дифракции и реконструкции изображения
Содержание
1. Кристаллизация мембранных белков
2. Реконструкция изображения и двумерные кристаллы
2.1 Реконструкция изображения
2.2 Три примера структурных исследований мембранных белков
3. Структура фотосинтетических реакционных центров ft. viridis и ft. sphaeroides
3.1 Вывернутый белок
3.2 Расположение спиралей в бислое и их соединение
4. Структура поринов
1. Кристаллизация мембранных белков
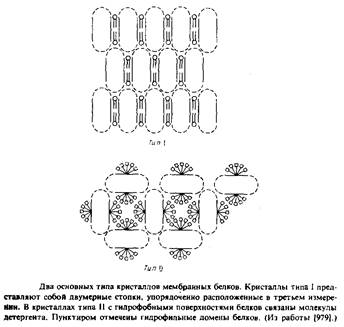
Наиболее детальную структурную информацию об очищенных мембранных белках можно получить, исследуя методом рентгеновской дифракции трехмерные белковые кристаллы. К сожалению, оказалось, что интегральные мембранные белки очень трудно кристаллизовать. Будучи удалены из своего естественного липидного окружения, неполярные участки липидных молекул склонны агрегировать с образованием неупорядоченных форм, непригодных для кристаллографического анализа. Ясно, что необходимы специальные методы, позволяющие обойти эти трудности, и в этом был достигнут определенный прогресс. Михель обратил внимание, что мембранные белки образуют кристаллы двух типов. Кристаллы типа I напоминают стопки мембран. В них осуществляется латеральное взаимодействие между неполярными участками, а мембраноподобные слои связывают полярные участки белков. Подобные кристаллы были получены для нескольких белков, но ни в одном случае их нельзя было исследовать с помощью дифракции с высоким разрешением. Кристаллы типа II стабилизируются за счет контактирования полярных участков белковых молекул, а небольшие амфифильные соединения или детергенты в основном заполняют промежутки между ними. Заметим, что очень важными являются размер, заряд и другие свойства детергентов; если эти параметры неблагоприятны, то детергент может дестабилизировать кристаллическую структуру.
Кристаллы типа II образуют белки фотосинтетического реакционного центра Rhodopseudomonasviridis. Имеются данные, что близка к завершению работа по установлению структуры матриксного порина с высоким разрешением из наружной мембраны Е. coli.
Итак, мембранные белки можно кристаллизовать, и хотя число Успешных попыток пока невелико, можно сделать несколько выводов, касающихся методологии кристаллизации.
1. Белки кристаллизуются вместе с детергентом.
2. Очень важен выбор детергента. По-видимому, наиболее при- годны цвиттерионные или неионные детергенты с высокой ККМ и Малым размером мицелл.
Таблица 1. Мембранные белки, которые были закристаллизованы
| Белок | Ссылки |
| 1. | Реакционный центр R. viridis " |
| 2. | Реакционный центр R. sphaeroides " |
| 3. | Реакционный центр фотосистемы 1 |
| циаиобактерий Phormidium laminosum | |
| 4. | OmpF |
| 5. | OmpA |
| " | |
| 6. | LamB |
| 7. | Бактериородопсин |
Кристаллизация облегчается в присутствии малых амфифиль-ных органических молекул, по-видимому влияющих на полярные концевые группы детергента. Так, белок реакционного центра R. viridis удалось закристаллизовать в присутствии 1,2,3-гептантриола.
Полиэтиленгликоль и сульфат аммония, обычно использующиеся при кристаллизации растворимых белков, применялись и для индукции кристаллизации мембранных белков.
В работе отмечалось, что условия кристаллизации в некоторых случаях близки к условиям, при которых детергент образует отдельную фазу. Роль, которую играет агрегация детергента в процессе кристаллизации белково-детергентных комицелл, неизвестна, но очевидно, что правильный выбор детергента очень важен.
2. Реконструкция изображения и двумерные кристаллы
Трехмерные кристаллы мембранных белков получить очень трудно, но многие из них образуют двумерные упорядоченные структуры. В некоторых случаях белки формируют такие структуры invivo,. При подходя-" щих условиях такие белки, как и многие другие, образуют "двумер-' ные кристаллы" при их очистке и реконструкции в присутствии фос-фолипидов. Подобные двумерные упорядоченные структуры можно, использовать для получения трехмерной структурной информации с, помощью электронной микроскопии и методов реконструкции изображения.
2.1 Реконструкция изображения
Эта методика исходно предназначалась для изучения вирусных частиц, а к мембранным белкам она была впервые применена Хендерсоном и Ануином, исследовавшими бактериородопсин. В принципе этот метод позволяет получить структурную информацию, достаточную для того, чтобы проследить ход полипептидной цепи, но реализовать эту возможность пока не удалось. Рассеяние электронов достаточно велико для того, чтобы визуализировать отдельные молекулы с помощью электронного микроскопа. Однако интенсивность пучка электронов, необходимая для этого, слишком велика, сам образец при этом разрушается, и для получения высокого разрешения приходится использовать гораздо меньшие интенсивности. В обычной трансмиссионной электронной микроскопии для усиления контраста используется негативное контрастирование, но оно непригодно для выявления структурных деталей тех участков белка, которые погружены в бислой, поскольку они недоступны для красителя. Красители редко используются для реконструкции изображения; исключение составляют лишь исследования по визуализации водных каналов.
Чтобы получить достаточную информацию с помощью пучка электронов низкой интенсивности, необходимо просуммировать изображения многих молекул. Именно с этой целью используют двумерные упорядоченные структуры. Сами изображения представляют собой двумерные проекции электронной плотности образца. Проведя оцифровку этих изображений и применив преобразование Фурье, можно выявить повторяющиеся элементы и устранить шумы. Еще раз применив преобразование Фурье к этим повторяющимся элементам, реконструируют исходное изображение, но уже без шумов. В основе процедуры лежит удачный прием, позволяющий суммировать изображения, полученные от сотен и тысяч молекул в поле зрения микроскопа.
Проекции электронной плотности в двух направлениях недостаточны для построения трехмерной структуры. Поэтому, наклоняя образец, получают проекции образца под разными углами и используют их для реконструкции трехмерного изображения объекта. Таким образом строят карту электронной плотности в мембране на Разных уровнях. Обычно приводят данные о профиле электронной плотности через каждые 15-25 А.
Таблица 2. Мембранные белки, структуру которых определяли методом реконструкции изображения
| Белок | Трехмерное разрешение, А | Ссылки |
| 1. NAPH: убихинон оксидоредуктаза (митохондрии) | 13 | [ИЗ] |
| 2. Цитохром с-оксидаза (митохондрии) | 20 | [314, 466] |
| 3. Убихинол-цитохром с - оксидоредуктаза (митохондрии) | 25 | [843] |
| 4. Свет ос обирающий комплекс, содержащий | 16 | [795] |
В табл.2 представлен список белков, которые были изучены этим методом. Во всех случаях, кроме бактериородопсина, уровень разрешения был достаточен только для очерчивания общих контуров молекул и определения их размеров.
Однако даже такая информация может быть очень ценной. Например, выяснилось, что многие из этих молекул в двумерных кристаллах существуют в виде отдельных мультимеров, а порин и бактериородопсин являются тримерами.
В случае порина существует четко наблюдаемый канал, в образовании которого на внешней поверхности клетки участвует каждый из трех отдельных полипептидов; сливаясь, эти полипептиды образуют одиночный канал на периплазматической поверхности наружной мембраны Е. coli.
Коннексин выглядит как гексамер, а ацетилхолиновый рецептор - как симметричный пентамер. Ферменты дыхательной цепи митохондрий, убихинолцитохром с-оксидоредуктаза и цитохромоксидаза, являются димерами, хотя неясно, существуют ли эти димеры invivo. Удивительно, как сильно белки иногда выступают над поверхностью бислоя.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--