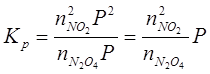Реферат: Хіміко-технологічні процеси - складова хімічного виробництва. Кінетичні закономірності гетерогенних хіміко-технологічних процесів
Система, що знаходиться в стані рівноваги характеризується наступними ознаками:
1)швидкості прямої та зворотної реакцій повинні бути однакові;
2)в системі не повинно виникати ні яких видимих змін;
3)система повинна бути ізольованою.
Кількісно стан рівноваги описується законом діючих мас:
При постійній температурі та наявності рівноваги відношення множення діючих мас продуктів реакції до діючих мас реагентів є величина постійна – константа рівноваги. Константу рівноваги можна розрахувати з визначення стану рівноваги, як рівність швидкостей прямої та зворотної реакцій.


У випадку аналізу реакцій, які протікають в газовій фазі, константу рівновагі виражають через порційні тиски.

Розрахунки константи рівноваги проводять через значення ізобарно-ізотермічного-потенціалу ![]() , згідно з рівнянням ізобари хімічної реакції:
, згідно з рівнянням ізобари хімічної реакції:
![]()
![]() ,
,
де ![]() - відповідно значення ентальпії та ентропії хімічної реакції, які розраховують за даними довідкових таблиць термодинамічних величин.
- відповідно значення ентальпії та ентропії хімічної реакції, які розраховують за даними довідкових таблиць термодинамічних величин.
Величина константи рівноваги вказує на ступінь завершеності хімічної реакції.
На при кінці 19-го сторіччя Анрі Ле Шател’є в короткому повідомленні на засіданні паризької академії наук сформулював свій славнозвісний принцип:
В системі, яку виведено зі стану рівноваги в результаті зовнішній дії, самотужки протікають зміни, що зменшують ці дії.
реакція хімічний реагент концентрація
1.4 Вплив умов протікання реакції на стан рівноваги
Якщо константа рівноваги велика, то концентрації продуктів великі у порівнянні з концентраціями реагентів. У такому випадку кажуть, що рівновагу зсунуто вправо, якщо константа рівноваги невелика, то рівновагу зсунуто вліво.
Якщо в рівноважній системі провести зміну концентрації, рівноважний склад суміші зміниться. Оскільки константа рівноваги величина постійна для даної температури (співвідношення діючих мас реагентів і продуктів), то збільшення концентрації реагентів призведе до збільшення концентрації продуктів та навпаки.
Вплив тиску на рівновагу системи, в який не має газів зовсім малий. Зміна тиску рівноважної суміші газів, не впливає на константу рівноваги та впливає на стан рівноваги. Наприклад, для процесу:
![]()
Константу рівноваги розраховують за рівнянням:
 ,
,
порційні тиски компонентів реакційної суміші можна виразити через мольні частки компонентів та загальний тиск в системі Р.
![]() ,
, ![]() ,
,
тоді константу рівноваги можна розрахувати: