Реферат: Хіміко-технологічні процеси - складова хімічного виробництва. Кінетичні закономірності гетерогенних хіміко-технологічних процесів
від концентрації називається кінетичним рівнянням і має вигляд:
![]() ,
,
де k – константа швидкості реакції,
a,b– порядки реакції за реагентами А та В.
Більшість хімічних реакцій протікають через череду проміжних стадій, які можуть ускладнюватися паралельними та послідовними реакціями. Константи та порядки реакції визначаються дослідним шляхом та залежать від умов проведення процесу.
Швидкість такої реакції по одному з реагентів дорівнює алгебраїчній сумі швидкостей елементарних стадій, в яких ця речовина приймає участь.
При визначенні знаків у членів цієї суми користуються правилом:
швидкість має позитивне значення, якщо вона визначається за продуктом реакції і негативне, якщо вона визначається за реагентом.
Залежність швидкості хімічної реакції від температури визначають за рівнянням Ареніусу:
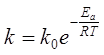 ,
,
де Еа – енергія активації процесу (визначається експериментально);
R – універсальна газова константа;
Т – абсолютна температура.;
k – константа швидкості процесу;
k0 – передекспонент.
Енергія активації в технологічних розрахунках має значення температурного коефіцієнту швидкості процесу.
2. Кінетичні закономірності гетерогенних хіміко-технологічних процесів
2.1 Швидкість гетерогенних ХТП
Гетерогенні процеси характеризуються наявністю двох або більше реагуючих фаз, тому вони проходять з переносом речовини через поверхню розділу фаз, таким чином – вони багатостадійні, це означає, що поруч з однією або кількома хімічними стадіями мають місце дифузійні стадії (перенос речовини від однієї фази до іншої).
Швидкість гетерогенного ХТП – число молей одного з реагентів або продуктів реакції, які реагують або утворюються в одиницю часу на одиниці поверхні розділу фаз.
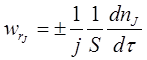
А швидкість дифузійного процесу:
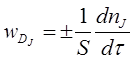
Швидкість гетерогенного ХТП не може бути більшою ![]() , тому що процеси переносу не приводять до утворення продукту, але не можуть бути більшою і
, тому що процеси переносу не приводять до утворення продукту, але не можуть бути більшою і ![]() , так як дифузія передує хімічній реакції.
, так як дифузія передує хімічній реакції.
Таким чином при аналізі гетерогенних ХТП виділяють два граничних випадки:
1) ![]() - процес проходить в дифузійній області, для збільшення продуктивності процесу необхідно зменшити дифузійне гальмування;
- процес проходить в дифузійній області, для збільшення продуктивності процесу необхідно зменшити дифузійне гальмування;
2) ![]() - процес проходить в кінетичній області і для збільшення продуктивності потребує інтенсифікації хімічної реакції.
- процес проходить в кінетичній області і для збільшення продуктивності потребує інтенсифікації хімічної реакції.
2.2 Кінетичні моделі гетерогенних процесів в системі «Г-Т»
Хімічні перетворення твердих речовин у контакті з газовою фазою часто супроводжуються виникненням нової стабільної або метастабільної твердої фази. Такі реакції відносять до топохімічних. Ці реакції можуть протікати як під дією імпульсів ззовні (термічного, магнітного, звукового, механічного, променевого і т.п.), так і внаслідок реакційної активності взаємодіючих речовин. При цьому знову утворена тверда фаза може бути стійкої або може розкладатися після деякого індукційного періоду. Прикладами топохімічних реакцій є: випал природної мінеральної сировини; розкладання кристалогідратів і інших подвійних сполук; обмінні гетерофазні реакції типу Г-Т; та ін.
Загальні закономірності перетворення твердої речовини в ході топохімічних процесів найкраще описуються рівнянням Єрофеєва: