Реферат: Хіміко-технологічні процеси - складова хімічного виробництва. Кінетичні закономірності гетерогенних хіміко-технологічних процесів
Вплив температури. Зміна температури змінює значення константи рівноваги відповідно до рівняння ізобари. Якщо ![]() (ендотермічна реакція) при збільшенні температури константа рівноваги збільшується. Якщо
(ендотермічна реакція) при збільшенні температури константа рівноваги збільшується. Якщо ![]() (екзотермічна реакція) при збільшенні температури константа рівноваги зменшується.
(екзотермічна реакція) при збільшенні температури константа рівноваги зменшується.
1.6 Кінетичні закономірності ХТП
Розрахунки рівноваги дозволяють визначити тільки максимально можливий ступінь перетворення компонентів сировини. Але, в умовах виробництва, які обмежені часом цей граничний ступінь перетворення не досягається із-за того, що знижується концентрація реагентів і як слідство – швидкість хімічних реакцій.
Рівняння, які описують залежність швидкості хімічної реакції від концентрації, називають кінетичними (кінетичними моделями), їх одержують в результаті кінетичних досліджень. Кінетичні моделі є основою математичної моделі хімічного реактору, їх використовують для вибору типу та розрахунку конструктивних розмірів реактору.
1.7 Швидкість гомогенних хімічних реакцій
Швидкістю хімічної реакції називають кількість молей одного з реагентів (продуктів), що реагують (або утворюються) в одиницю часу в одиниці реакційного простору (об’єму реактору).
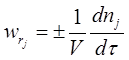 ,
,
де V – об’єм реактору;
dnj - зміна кількості молей реагенту ;
dτ – незначний проміжок часу.
Так як ![]()
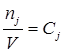 , тоді швидкість реакції можна виразити через концентрацію реагенту:
, тоді швидкість реакції можна виразити через концентрацію реагенту:
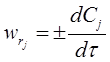 ,
,
Знак перед похідною вказує на напрям змінення концентрації, якщо це швидкість визначається за реагентом, він витрачається, концентрація зменшується (-), якщо швидкість було визначено за продуктом, то він утворюється, його концентрація росте (+).
Якщо реакція описується рівнянням:
![]() ,
,
то зміни кількості молей речовин-учасників реакції пов’язані між собою наступним співвідношенням:
![]() .
.
Таким чином числові значення швидкостей реакції розраховані за різними реагентами мають відрізнятися одне від одного, та проте пов’язані між собою співвідношенням:
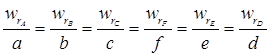
Для приведення швидкості до єдиного виду, такому, що б можна було судити про її зміну по будь-якому компоненту, використовують рівняння швидкості в такій формі:
![]() ,
,
де j – стехіометричний коефіцієнт.
1.8 Залежність швидкості хімічних реакцій від концентрації реагентів
Фактори, які впливають на швидкість хімічних реакцій поділяють на дві групи:
- чисто кінетичні (мікрокінетичні) – визначають швидкість взаємодії на молекулярному рівні;
- макрокінетичні, які визначають вплив на швидкість транспорту реагентів до зони реакції, наявність або відсутність перемішування та геометричних розмірів реактору.
Швидкість гомогенної реакції пропорційна концентраціям реагентів.
Сумарна швидкість декількох послідовних перетворень, які значно відрізняються за швидкістю, визначається за швидкістю найповільнішої стадії.
Функціональна залежність швидкості реакції