Реферат: Культивирование, идентификация и очистка герпесвирусов
Р-субгруппа герпесвирусов включает в себя цитомегаловирусы различных животных. Цитомегаловирусы человека вызывают различные заболевания, особенно у людей с ослабленной иммунной системой, а также в период беременности. Инфекция этими вирусами довольно часто приводит к смертельному исходу либо вызывает сильнейшее истощение больных с естественной или искусственной иммунной супрессией. Во время беременности этот вирус может вызвать уродства плода, выкидыши и повышенную чувствительность новорожденных к тяжелым инфекциям после родов. Именно по этим причинам в последние 10 лет резко возросла интенсивность изучения цитомегаловируса. Тем не менее, в этой области в отличие от вирусов простого герпеса не достигнуто значительного прогресса.
2.1 Получение заготовок вируса
Репликативный цикл цитомегаловируса человека продолжительнее, чем штаммов ВПГ. Кроме того, данный вирус прочно ассоциирован с клеткой и имеет высокую клеточную специфичность. Хотя во многих лабораториях для наращивания этого вируса используют клетки MRC-5, Flow 5000 или Нер-2, В. Гибсон рекомендует ранние пассажи на фибробластах крайней плоти человека или клетках легкого эмбриона человека. Гибсон культивирует перечисленные клетки в среде DMEM, содержащей 4500 мг/л глюкозы и 10% ЭТС. В нашей лаборатории используют клетки MRC-5, культивируемые в среде Игла в модификации Glasgow с 10% ЭТС. Заготовки вируса получают следующим образом:
1. Не дожидаясь образования плотного монослоя, добавляют CMV в минимальном объеме среды. Адсорбцию вируса проводят 1–2 ч при 37°С.
2. После адсорбции к клеткам добавляют необходимый объем культуральной среды и инкубируют их при 37°С.
3. Через 7–10 дней после заражения старую культуральную среду заменяют на свежую. Клетки продолжают инкубировать при 37°С до выявления признаков ЦПД.
4. Культуры ежедневно просматривают. Когда ЦПД достигнет своего максимума, клетки собирают в культуральную среду и центрифугируют 10 мин при 2000 об/мин. Собирают супернатант.
5. Осадок ресуспендируют в небольшом объеме культуральной среды, разрушают в ультразвуковой бане и хранят при –70°С.
6. Большая часть вируса содержится в культуральной среде, поэтому супернатант, полученный на стадии 4, центрифугируют 2 ч при 12000 об/мин в роторе GSA.
7. Полученный осадок ресуспендируют в небольшом объеме культуральной среды, осторожно разрушают в ультразвуковой бане и хранят при –70°С. Данный вирус не так стабилен при –70°С, как ВПГ. Поэтому его не следует подвергать частым замораживаниям и оттаиваниям. Оттаивание CMV, как и ВПГ, следует проводить быстро в теплой воде.
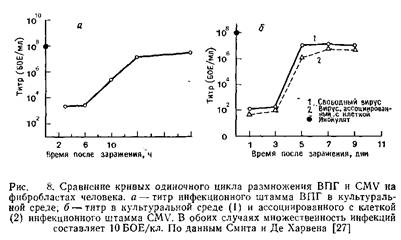
2.2 Цикл размножения
Смит и Де Харвен сравнили кривые роста ВПГ и CMV и определили время наступления тех или иных фаз инфекции. Результаты этих исследований приведены на рис. 8 и в табл. 2. Однако остается непонятным, насколько точно отражают данные кривые последовательность событий в зараженной клетке. Как уже отмечалось выше, цикл размножения CMV значительно длиннее, чем ВПГ.
Таблица 2. Время наступления основных этапов инфекции CMV и ВПГ. Сравнительные данные, полученные при помощи электронной микроскопии
| Этапы | Начало события | |
| CMV | ВПГ | |
| Слияние клеток и округление | 0,5 | 6 |
| Изменения аппарата Гольджи | 1 | 8 |
| Скрытый период | 2 | 2 |
| Появление большого количества гранул, напоминающих перихроматин | 2 | 3 |
| Конденсация хроматина | Не наблюдается | 3 |
| Сборка в ядрах первых капсидов | 3 | 4 |
| Появление первых капсидов, имею- | 3,5 | 5 |
| щих плотную сердцевину | ||
| "Одевание" ядерной мембраной | 3,5 | 6 |
| Появление "голых" капсидов в цито- | 4 | 6 |
| плазме | ||
| Появление плотных цитоплазматиче-ских агрегатов | 4 | Не наблюдается |
| Первые высвободившиеся из клетки частицы | 4 | 8 |
| Удвоение ядерной мембраны | 4 | 8 |
| "Одевание" цитоплазматической мембраной | 4 | 8 |
| Лизис клетки | 7–8 | 24–48 |
2.3 Идентификация вируса
Множество попыток было предпринято для разработки удобных методов титрования медленно растущих вирусов. В большинстве лабораторий остановились на методе определения конечной точки TCID50 . Сложность данной проблемы заключается в сохранении клеточного монослоя в течение времени, необходимого для формирования бляшек. В нашей лаборатории используют следующую модификацию метода бляшек, рекомендованную Вентвесом и Френчем:
1. Клетки линии MRC-5 высевают в 24-луночные планшеты или в чашки Петри диаметром 30 мм для культивирования клеток. Культуры, достигшие состояния монослоя, инфицируют вирусом, разведенным в 200 мкл культуральной среды.
2. По истечении первого часа адсорбции среду заменяют на 1%-ную агарозу, приготовленную на культуральной среде с 2% ЭТС. Клетки инкубируют при 37°С.
3. Через неделю еще раз добавляют необходимое количество агарозы и продолжают инкубацию при 37°С.
4. Через 2–3 нед с момента заражения под микроскопом удается обнаружить небольшие очаги инфицированных клеток. Незадолго до того, как разрушится монослой неинфицированных клеток, культуры фиксируют в забуференном формалине, осторожно удаляют агарозу и окрашивают 1%-ным генцианвиолетом. Небольшие очаги инфекции можно подсчитать под стереомикроскопом. Вместо генцианвиолета культуры можно окрашивать 1%-ным нейтральным красным. Кроме того, нам удалось получить бляшки CMV, используя КМЦ вместо агарозы.
2.4 Метод черных бляшек
Этот метод может быть использован для идентификации любых вирусов. Однако особенно удобен он оказался для CMV, образующего бляшки малого размера.
1. Культуры, достигшие монослоя, инфицируют обычным способом.
2. Через 6–7 дней после заражения удаляют КМЦ и клетки трижды промывают PBS. Затем в течение 5 мин клетки фиксируют 0,25%-ным раствором глутарового альдегида в PBS.
3. Отмыв фиксатор с помощью PBS, добавляют соответственно разведенную антисыворотку или моноклональные антитела против CMV. Клетки оставляют при комнатной температуре на 2 ч.
4. Клетки отмывают от антител PBS и инкубируют 3 ч при комнатной температуре со вторыми, обычно конъюгированными с пероксидазой хрена антителами против первых антител.
5. После трехкратной промывки в PBS в каждую культуру добавляют субстрат Hanker-Yates, 50 мл 0,1 M трис-HCl, pH 7,5, и 0,5 мл 1%-ной H2 02 ). Окраска проявляется в течение 5–30 мин.
6. Чашки промывают дистиллированной водой, переворачивают и дают им высохнуть в темноте. Темноокрашенные бляшки вируса идентифицируют и подсчитывают.
2.5 Культивирование и очистка CMV