Реферат: Квантовая теория атома
серия Хэмфри (ИК диапазон)
n = 7, 8, 9 …
Вид формул, симметричность и повторяемость целых чисел (m, n), универсальность постоянной Ридберга привело к предположению об особой физической роли чисел mиn– квантовых чисел, определяющих параметры состояния атомов.
Первая неклассическая теория атома была предложена в 1913 г. Н.Бором. При этом Бор не отказался от описания поведения электронов в атоме законами классической физики. Но для того, чтобы совместить линейчатость спектров излучения атомов и ядерную модель Резерфорда, Бор в виде постулатов ввел некоторые предположения, которые, строго говоря, противоречили классической физике, и, тем не менее, приводили к абсолютно правильным результатам.
Iпостулат Бора (постулат стационарных состояний):
Существуют стационарные состояния атома, характеризующиеся определенными дискретными значениями энергии, в которых атом не излучает энергию.
Этим стационарным состояниям атома соответствуют стационарные орбиты, по которым вращаются электроны. При движении по стационарным орбитам электроны, несмотря на наличие у них ускорения, не излучают электромагнитных волн.
Правило квантования орбит Бора: в стационарном состоянии атома электрон, двигаясь по круговой стационарной орбите, может иметь только дискретные (квантованные) значения момента импульса, удовлетворяющие условию Len = pe ·rn = me ·vn ·rn = n ћ,
гдеn = 1, 2 …, ћ= h/2π, vn – скорость электрона на стационарной орбите радиусом rn .
Это условие может быть сформулировано в виде условия квантования длины стационарной орбиты электрона: так как  ,
,  , т.е. на длине стационарной орбиты электрона должно укладываться целое число длин волн де Бройля.
, т.е. на длине стационарной орбиты электрона должно укладываться целое число длин волн де Бройля.
Понятие орбиты электрона. С точки зрения квантовой механики орбита электрона – это геометрическое место точек, в которых с наибольшей вероятностью может находиться электрон.
II постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается один фотон с энергией hν = Еn –Еm ,
где Еn , Еm – энергии соответствующих стационарных состояний.
Излучение (испускание фотона) происходит при переходе атома из состояния с большей энергией в состояние с меньшей энергией: Еn > Еm . Электрон при этом переходит с более удаленной от ядра орбиты на более близкую.
Поглощение фотона сопровождается переходом атома в состояние с большей энергией: Еn < Еm , электрон переходит на более удаленную от ядра орбиту.
Набор возможных дискретных частот ![]() квантовых переходов и определяет линейчатость спектров излучения атомов. Становится ясен физический смысл целых чисел в формулах Бальмера:
квантовых переходов и определяет линейчатость спектров излучения атомов. Становится ясен физический смысл целых чисел в формулах Бальмера:  , следовательно, энергия атома в n – ном стационарном состоянии
, следовательно, энергия атома в n – ном стационарном состоянии  , где n = 1, 2, 3 … Таким образом, целые числа nи mиз «сериальных» формул – это квантовые числа, определяющие дискретные квантованные значения энергии атомов.
, где n = 1, 2, 3 … Таким образом, целые числа nи mиз «сериальных» формул – это квантовые числа, определяющие дискретные квантованные значения энергии атомов.
Водородоподобные системы по Бору.
Водородоподобные системы состоят из ядра с зарядом Z·qe и одного электрона, вращающегося вокруг ядра. Например: атом водорода (при Z= 1); ионизованные атомы He+ , Li++ или другие атомы, из которых удалены все электроны, кроме одного.
Для водородоподобных систем из II -го закона Ньютона движения электрона по круговой орбите  и правила квантования орбит (me ·vn ·rn = nћ, т.е.
и правила квантования орбит (me ·vn ·rn = nћ, т.е.  ) можно определить радиус n – ой орбиты электрона:
) можно определить радиус n – ой орбиты электрона:  .
.
Для водорода (т.е. Z = 1) для основного состояния (т.е. n = 1) радиус первой орбиты электрона называется Боровским радиусом и обозначается а0 :
 .
.
Вообще, энергетическое состояние с n = 1 называется основным или нормальным (невозбужденным), а все состояния атомов с n > 1 – возбужденными.
Полная энергия электрона в водородоподобной системе равна сумме кинетической энергии электрона и его потенциальной энергии в поле ядра:  .
.
Так как  (из *), то
(из *), то  или подставляя
или подставляя  , получаем выражение для энергии электрона в n – ном стационарном состоянии:
, получаем выражение для энергии электрона в n – ном стационарном состоянии:
 , где n = 1, 2, 3 …
, где n = 1, 2, 3 …
Для атома водорода (Z = 1): 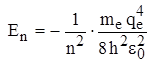 , и для основного невозбужденного состояния (n = 1)
, и для основного невозбужденного состояния (n = 1) 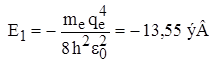 .
.
Из сравнения данного выражения для Еn и Еn из формулы Бальмера можно получить постоянную Ридберга: 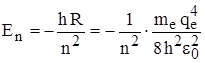 и тогда
и тогда 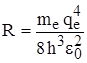 .
.
Физический смысл знака «–» в формуле для энергии электрона (энергия отрицательна) заключается в том, что электрон в атоме под действием силы притяжения к ядру находится в связанном состоянии. |Еn | называется энергией связи (энергией отрыва) электрона в n – ом состоянии; а состояние с n = ∞ соответствует свободному состоянию электрона, т.е. Е∞ = 0.
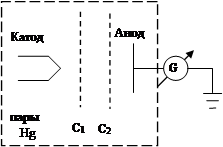
Экспериментальным подтверждением постулатов Бора явились опыты Франка – Герца (1913 г.) по изучению столкновений электронов с атомами газов (в частности, паров ртути) методом задерживающего потенциала.