Реферат: Квантовая теория атома
Определим для этого случая постоянную С. Условие нормировки вероятности на единицу имеет вид 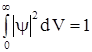 . Подставляя выражение для
. Подставляя выражение для ![]() с учетом того, что
с учетом того, что ![]() , получаем
, получаем 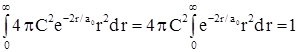 .
.
Воспользовавшись соотношением 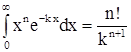 (для нашего случая
(для нашего случая 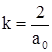 и
и ![]() ), получаем
), получаем 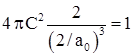 или
или ![]() и окончательно
и окончательно  .
.
Тогда нормированная волновая функция  .
.
Собственные значения уравнения Шредингера, определяющие энергию электрона в атоме, совпадают с полученными ранее по теории Бора:
 или
или  где n = 1, 2, 3 …
где n = 1, 2, 3 …
Таким образом, энергетические уровни стационарных состояний электрона определяются только главным квантовым числом n.
Каждому значению n соответствует l = 0, 1 ,2 …(n – 1), всего nзначений,
каждому значению lсоответствует m = 0, ±1, ±2, …. ± l, всего (2l + 1) значений. Следовательно, каждому значению nсоответствует ![]() возможных ψ – функций, т.е. кратность вырождения энергетических уровней равна n2 .
возможных ψ – функций, т.е. кратность вырождения энергетических уровней равна n2 .
C9-4

Значение квантовых чисел как следствие стационарного уравнения Шредингера:
n– главное квантовое число, определяющее энергетические уровни электрона в атоме,
n = 1, 2, 3 …
l– орбитальное (азимутальное) квантовое число, определяющее момент импульса электрона в атоме (механический орбитальный момент), l = 0, 1, 2, … (n – 1).
Одним из важнейших следствий уравнения Шредингера является квантование орбитального момента импульса электрона: ![]() ,
,
т.е. модуль орбитального момента может принимать лишь значения, кратные ћ и определяемые орбитальным квантовым числом l.
m– магнитное квантовое число, задающее проекцию момента импульса электрона на направление внешнего магнитного поля, m= 0, ±1, ±2, … ± l.

В квантовой механике существует строгое доказательство того, что вектор ![]() момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llz на направление внешнего магнитного поля (OZ) принимает квантованные значения, кратные ћ и определяемые магнитным квантовым числом m:Llz = ћ·m.
момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llz на направление внешнего магнитного поля (OZ) принимает квантованные значения, кратные ћ и определяемые магнитным квантовым числом m:Llz = ћ·m.
Это следствие решения уравнения Шредингера для водородоподобных систем называется пространственным квантованием.
Как уже говорилось, понятие орбиты электрона в квантовой механике носит вероятностный характер. Вероятность обнаружения электрона в единичном объеме отличается в различных точках пространства и может
быть определена через волновую

функцию ![]()
По теории Бора вероятность dw ≠ 0 только для r = a0 (для n= 1). При квантово-механическом рассмотрении существует ненулевая вероятность обнаружения электрона в любой точке пространства, но эта вероятность имеет максимальное значение в окрестности r = a0 : электрон как бы «размазан» в пространстве, образуя электронное облако, густота (плотность) которого характеризует вероятность нахождения в данной точке. При этом квантовые числа nи lопределяют размер и форму электронного облака, а m характеризует ориентацию облака в пространстве.
Описание состояние электронов в атоме. В зависимости от квантовых чисел вводится определенная символика обозначения состояния электрона:
| l = 0 | S - состояние | Shapp (резкая) серия излучения |
| l = 1 | p - состояние | Principal (главная) |
| l = 2 | d - состояние | Diffuse (диффузная) |
| l = 3 | f - состояние | Fundamental (основная), |
| и далее по английскому алфавиту (g, h …) | ||
Значение главного квантового числа nуказывается перед орбитальным числом l:
1S (n = 1, l =0, m = 0)
2S (n = 2, l =0, m = 0), 2p (n = 2, l =1, m= ±1)