Реферат: Локалізація та розподіл ферментних систем у рослинній клітині
Виконала:
студентка ІІІ курсу 32 групи
природничого факультету
спеціальність «Біологія. Хімія»
Чернишенко Лілія Юріївна
Перевірила:
доцент кафедри ботаніки, к.б.н.
Перепелиця Л.О.
Житомир – 2010
План
Вступ
1 Історія дослідження ферментів
2 Структура і механізм дії ферментів
3 Функції ферментів
4 Класифікація ферментів
5 Локалізація ферментів у клітині
6 Створення нових ферментів
Висновки
Список літератури
Вступ
Актуальність теми: тема вивчається для глибокого розуміння фізіологічних процесів, що протікають в рослинній клітині. Знання теми необхідні для кращого сприйняття інших тем, наприклад, «Фотосинтез», «Біосинтез білку». Адже ферменти беруть участь у всіх хімічних реакціях, що відбуваються в живому організмі.
Мета: викласти матеріал, що стосується ферментних систем рослинної клітини; показати роль ферментів в процесах життєдіяльності; з’ясувати їх функції та будову.
1 Історія дослідження ферментів
Вивчення ферментів почалось з дослідження головним чином двох біологічних процесів – перетравлення їжі тваринами та бродіння цукру з утворенням спирту під дією дріжджів. Можна вважати, що вперше дію ферментів спостерігав у 1833 році А. Пайєн та Ж. Персо, які встановили, що спирт осаджує з солоду якусь речовину, що здатна перетворювати крохмаль в цукор. Пайєн і Персо назвали це активне начало діастазою (від грецького «роз’єднання») і показали, що воно руйнується при нагріванні. Введений термін «діастаза» застосовували протягом деякого часу в якості загальної назви для усіх ферментів. Але на перших етапах цього дослідження було встановлено, що бродіння під дією дріжджів представляє собою каталітичний процес. Звідси і виникло поняття фермент (від латинського fermentum – бродіння, закваска).
В кінці 19 століття між хіміком М. Бертло та батьком мікробіології Луї Пастером виникла суперечка про природу бродіння. Бертло вважав, що цей процес обумовлюється утворенням каталізаторів (ферментів) живими клітинами дріжджів. Пастер вважав, що здатність викликати бродіння притаманна тільки живим клітинам дріжджів, що діляться, та ніяк не відокремлена від них.
У 1878 році німецький фізіолог В. Кюне запропонував назву «ензим» (від грецького – в «заквасці») не тільки для активного начала дріжджів, а й для інших ферментів. У 1897 році Е. Бухнер встановив дуже цікавий факт. Він показав, що якщо зруйнувати клітини дріжджів, розтираючи їх з піском, та віджати з них сік, цей сік може швидко зброджувати цукор. Це відкриття спричинило кінець дискусії між послідовниками Пастера та Бертло. Було розпочато роботу по виділенню та очищенню ферментів.
В наш час кількість ідентифікованих ферментів становить більше 800. Для того, щоб було відомо про який фермент йде мова, була введена формальна система класифікації та нумерації всіх відомих ферментів. Але ферменти мають ще й «тривіальні» назви, що використовуються в розмові, а також в науковій літературі. Правило для тривіальних назв було запропоновано Е. Дюкло у 1898 році. Згідно з цим правилом назва ферменту утворюється шляхом додавання закінчення –аза до слова (чи його частини), що позначає речовину, на яку діє цей фермент. (Речовина, на яку діє фермент, називається субстратом.) Наприклад, фермент, що діє на цукор, повинен називатися сахаразою; фермент, що діє на жири – ліпазою і т.д.
З часом список ферментів збільшувався і ставало зрозумілішим, що на один і той же субстрат може діяти більш ніж один фермент, але кожен з них діє по своєму. Тому було змінено номенклатуру ферментів так, що кожна назва відображала тип хімічної зміни, що викликається даним ферментом. Таким чином, пропозиція Дюкло зумовила створення простого методу присвоєння ферментам назв, в яких міститься відома інформація про них.
2 Структура і механізм дії ферментів
Активність ферментів визначається їхньою тривимірною структурою. В ранніх дослідженнях було отримано багато доказів того, що ферменти – це білки. Нездатність проходити крізь напівпроникну мембрану, особливості їх розчинності, денатурація при нагріванні і в сильному лужному чи кислотному середовищі – всі ці властивості ферментів співпадають зі звичайними характеристиками білків. В наш час багато ферментів отримано в чистому вигляді та проаналізовано їх будову. У всіх випадках доведено, що вони являють собою білки. Як і всі білки, ферменти синтезуються у вигляді лінійного ланцюжка амінокислот, який згортається певним чином. Кожна послідовність амінокислот згортається особливим чином, і молекула (білкова глобула), що виходить, володіє унікальними властивостями. Кілька білкових ланцюжків можуть об'єднуватися у білковий комплекс.(Рис.1) Найбільші рівні структури білків — третинна та четвертинна структури — руйнуються при нагріванні або під дією деяких хімічних речовин.
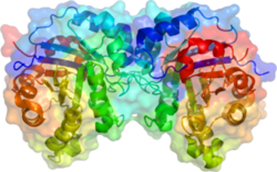
Рис.1. Просторова структура тріозфосфат-ізомерази
Щоб каталізувати реакцію, фермент повинен зв'язатися з одним або кількома субстратами. Білковий ланцюжок ферменту згортається таким чином, що на поверхні глобули утворюється щілина або западина, до якої приєднуються молукули субстрату. Ця область називається ділянкою (сайтом) зв'язування субстрата. Зазвичай вона співпадає з активним центром ферменту або знаходиться поблизу від нього. Деякі ферменти містять також ділянки зв'язування кофакторів або іонів металів.
У деяких ферментів присутні також ділянки зв'язування малих молекул, що не беруть безпосередньої участі в реакції і часто, але не обов'язково, є субстратами або продуктами метаболічного шляху, в який входить фермент. Вони зменшують або збільшують активність ферменту, що створює можливість для зворотного зв'язку або регуляції роботи ферменту.Для активних центрів деяких ферментів характерне явище кооперативності.
Специфічність
Одна з найбільш характерних властивостей ферментів – це їх специфічність, в міру якої кожен фермент діє тільки на одну речовину або дуже невелику кількість споріднених речовин. Специфічність дії ферментів – найважливіше біологічне явище, без якого неможливий впорядкований обмін у живій природі, відповідно і саме життя. Концентрація каталізатора – розмір його активної поверхні – визначає швидкість змін, що відбуваються під його впливом. Високо специфічні каталізатори визначають які саме речовини підлягають перетворенню. Специфічність каталізаторів завдяки своїй структурі визначає серед багатьох шляхів той єдиний шлях, за яким повинна йти реакція. Він має здатність направляти реакцію по одному шляху. Цю напрямленість надають процесам обміну внутрішньоклітинні ферменти. Якщо б ферменти на мали специфічності, їх дія призводила б до швидкого розпаду клітинного матеріалу і при цьому не відбувалося б біосинтезу.
Ступінь специфічності у різних ферментів варіює. В більшості випадків фермент діє тільки на одну речовину і каталізує лише одну реакцію. В інших випадках фермент може діяти на ряд близькоспоріднених речовин, каталізуючи кожен раз одну й ту ж саму реакцію. Ферменти демонструють високий рівень стереоспецифічності (просторової специфічності), регіоселектівності (специфічності орієнтації) і хемоселектівності (специфічності до хімічних груп).
Модель «ключ-замок»
--> ЧИТАТЬ ПОЛНОСТЬЮ <--