Реферат: Локалізація та розподіл ферментних систем у рослинній клітині
Крива насичення хімічної реакції (рівняння Міхаеліса-Ментен), що ілюструє співвідношення між концентрацією субстрата [S] і швидкістю реакції V.(Рис.2) Найпростішим і найпоширенішим описом кінетики односубстратних ферментатівних реакцій є рівняння Міхаеліса-Ментен. На сьогоднішній момент описано і кілька складніших типів кінетики ферментів. Наприклад, якщо реакція вимагає кількох молекул субстрата або різних субстратів, часто реакція протікає через утворення третинного комплексу. Для дії багатьох ферментів також типове утвореня перехідних комплексів (станів), що описується «механізмом пінг-понг».
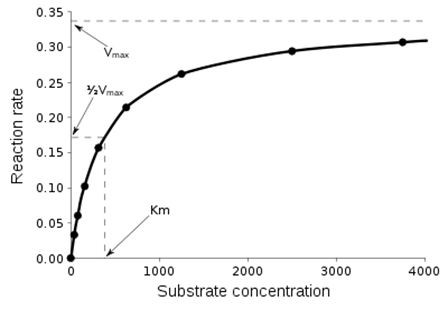
Рис.2. Крива насичення хімічної реакції
3 Функції ферментів
Ферменти є біологічними каталізаторами, вони присутні у всіх живих клітинах і сприяють перетворенню одних речовин (субстратів) на інші (продукти). Ферменти виступають в ролі каталізаторів практично у всіх біохімічних реакціях, що відбуваються в живих організмах — ними каталізується біля 4000 хімічно окремих біореакцій. Ферменти грають найважливішу роль у всіх процесах життєдіяльності, скеровуючи та регулюючи обмін речовин організму. Подібно до всіх каталізаторів, ферменти прискорюють як пряму, так і зворотну реакцію, знижуючи енергію активації процесу. Хімічна рівновага при цьому не зміщується ні в прямий, ні у зворотний бік. Відмінність ферментів від небілкових каталізаторів полягає у їхній високій специфічності — константа дисоціації деяких субстратів з білком-ферментом може досягати менш ніж 10−10 моль/л. Ферменти широко використовуються і в народному господарстві — харчовій, текстильній промисловості, у фармакології.
4 Класифікація ферментів
Комісія по ферментам у 1961 році розробила засновану на класифікації систему присвоєння кодових чисел (шифрів) індивідуальним ферментам. Шифр кожного ферменту складається з чотирьох чисел і створюється за наступним принципом.
- Перше число вказує до якого з шести головних класів належить даний фермент:
1. КФ 1: Оксидоредуктази — ферменти, що каталізують окислення або відновлення. Приклад: каталаза, алкогольдегідрогеназа
2. КФ 2: Трансферази — ферменти, що каталізують перенесення хімічних груп з однієї молекули субстрата на іншу. Серед трансфераз особливо виділяють кінази, що переносять фосфатну групу, як правило, з молекули АТФ.
3. КФ 3: Гідролази — ферменти, що каталізують гідроліз хімічних зв'язків. Приклад: естерази, пепсин, трипсин, амілаза, ліпопротеїнліпаза
4. КФ 4: Ліази — ферменти, що каталізують розрив хімічних зв'язків без гідролізу з утворенням подвійного зв'язку в одному з продуктів.
5. КФ 5: Ізомерази — ферменти, що каталізують структурні або геометричні зміни в молекулі субстрата.
6. КФ 6: Лігази — ферменти, що каталізують утворення хімічних зв'язків між субстратами за рахунок гідролізу АТФ. Приклад: ДНК-полімераза
- Друге число означає підклас. У оксидоредуктаз воно вказує природу тієї групи в молекулі донора, яка піддається окисленню; у трансфераз – природу групи, що транспортується; у гідролаз – тип зв’язків, що гідролізуються; у ліаз – тип зв’язків, що підлягають розриву; у ізомераз – тип реакції ізомеризації, що каталізується; у лігаз – тип утвореного зв’язку.
- Третє число означає підпідклас.
- Четверте число вказує порядковий номер ферменту в даному підпідкласі.
Зазвичай ферменти іменують за типом реакції, яку він каталізує, додаючи суфікс -аза до назви субстрату (наприклад лактаза — фермент, що бере участь в перетворенні лактози). Таким чином, у різних ферментів, що виконують одну функцію, буде однакова назва. Такі ферменти розрізняють по інших властивостях, наприклад, по оптимальному pH (лужна фосфатаза) або локалізації в клітині (мембранна АТФ-аза).
Оксидоредуктази — клас ферментів, що каталізують реакції окислення, тобто перенесення електронів з однієї молекули (відновника, донора електронів) на іншу (окислювач, акцептор електронів).
Реакції, що каталізуються оксидоредуктазами, виглядають так:
A- + B → A + B-
Тут A — відновник (донор електронів), а B — окислювач (акцептор електронів)
У біохімічних перетвореннях окислительно-відновні реакції іноді виглядають складнішими. Наприклад, одна з реакцій гліколізу:
Pн + гліцеральдегид-3-фосфат + НАД+ → НАД · H + H+ + 1,3-діфосфогліцерат
Тут окислювачем виступає НАД+, а гліцеральдегид-3-фосфат є відновником.
Систематичні назви ферментів класу утворюються по схемі «донор:акцептор + оксидоредуктаза». Проте широко використовуються й інші схеми іменування. Коли можливо, ферменти називають у вигляді «донор + дегідрогеназа», наприклад гліцеральдегид-3-фосфатдегідрогеназа, для другої реакції вище. Іноді назва записується як «акцептор + редуктаза», наприклад НАД+-редуктаза. У окремому випадку, коли окислювачем є кисень, назва може бути у вигляді «донор + оксидаза». Згідно з міжнародною класифікацією ферментів, оксидоредуктази відносяться до 1 класу ферментів, в межах якого виділяють 22 підкласи:
· КФ 1.1 — ферменти, що взаємодіють з CH—OH—групою донорів;
· КФ 1.2 — ферменти, що взаємодіють з альдегідною або оксо-групою донорів;
· КФ 1.3 — ферменти, що взаємодіють з CH—CH—групою донорів;
· КФ 1.4 — ферменти, що взаємодіють з CH—NH2 групою донорів;
· КФ 1.5 — ферменти, що взаємодіють з CH—NH групою донорів;
· КФ 1.6 — ферменти, що взаємодіють з НАД · H або НАДФ · H;
· КФ 1.7 — ферменти, що взаємодіють з іншими азотовмісними сполуками в якості донорів;
· КФ 1.8 — ферменти, що взаємодіють з сірковмісною групою донорів;