Реферат: Нитрование ароматических углеводородов. Производство нитро-бензола
и при нагревании регенерируют BF3 :
![]() Ca(BF4 )2 2BF3 + CaF2
Ca(BF4 )2 2BF3 + CaF2
Особенности проведения нитрования зависят как от использующихся реагентов, так и от субстрата реакции.
Реагенты для проведения реакции нитрования:
1. HNO3 (63-65%, d 1.35 г/мл, товарный продукт) + H2 SO4 (96%). Наиболее распространенный.
2. HNO3 (98%, d 1.5 г/мл, также товарный продукт) + H2 SO4 (96%-100 %). Для мало реакционноспособных соединений.
3. HNO3 (98%) + SO3 (4-63%), олеум. Для очень мало реакционноспособных соединений.
4. К(Na)NO3 или NH4 NO3 + H2 SO4 (96%). Распространенный реагент для получения полинитропроизводных.
5. HNO3 (98%, d 1.5 г/мл) + (CH3 CO)2 O (или СН3 СООН). Для реакционноспособных соединений, селективный реагент. Реагент дорогой, поэтому необходимо обосновать экономическую целесообразность его использовании.
6. HNO3 (d 1,3 - 1,5). Для реакционноспособных соединений. Осложнение – побочная реакция окисления.
1.2. Кинетика процесса нитрования
Нитрование ароматических углеводородов смесями азотной и серной кислот протекает по ионному механизму. В. В. Марковников указал, что при взаимодействии серной и азотной кислот образуется нитросерная кислота:
![]()
![]() HNO3 + H2 SO4 HOSO2 -ONO2 + H2 O
HNO3 + H2 SO4 HOSO2 -ONO2 + H2 O
В дальнейшем было установлено (Титов, Инголд, Беннет), что нитросерная кислота в водной среде диссоциирует с образованием нитроний-катиона:
![]() H2 O
H2 O
![]() HOSO2 -ONO2 NO2 + + HSO4 -
HOSO2 -ONO2 NO2 + + HSO4 -
Ионы нитрония образуются и в концентрированной (безводной) азотной кислоте, не содержащей серной кислоты:
![]()
![]() 2HNO3 NO3 H+ + NO3 -
2HNO3 NO3 H+ + NO3 -
![]() NO3 H2 + NO2 + + H2 O
NO3 H2 + NO2 + + H2 O
При добавлении воды к азотной кислоте диссоциация HNO3 c образованием нитроний-катиона NO2 + подавляется почти полностью, концентрация этих ионов становится ничтожно малой.
Серная кислота реагирует не только с азотной кислотой, но и с водой, образуя ион гидроксония H3 O+ и бисульфатный анион HSO4 - :
![]()
![]() H2 SO4 + H2 O H3 O+ + HSO4 -
H2 SO4 + H2 O H3 O+ + HSO4 -
Таким образом, процесс взаимодействия азотной и серной кислот можно выразить следующим уравнением:
|
![]()
![]() HNO3 + 2H2 SO4 NO2 + + H3 O+ + 2HSO4 - (1)
HNO3 + 2H2 SO4 NO2 + + H3 O+ + 2HSO4 - (1)
Следовательно, главным активирующим действием серной кислоты является превращение азотной кислоты в наиболее сильное нитрующее средство – нитроний-катион NO2 +
В безводной азотной кислоте (без серной кислоты) концентрация иона нитрония составляет около 2 % вследствие самодегидратации.
![]()
![]() 2HNO NO2 + + NO3 - + H2 O (2)
2HNO NO2 + + NO3 - + H2 O (2)
Существование NO2 + доказано с помощью спектров комбинационного рассеяния (наблюдается интенсивная полоса при 1400 см-1 ). В растворах HNO3 + H2 SO4 ; HNO3 + HClO4 ; HNO3 + HBF4 азотная кислота практически полностью ионизована, были выделены в твердом виде соли катиона нитрония NO2 + X- (X = ClO4 , HSO4 , BF4 ). Добавление воды к концентрированной азотной кислоте приводит к уменьшению содержания иона NO2 + , и при наличии более 5 % воды его сигнал в спектре КР исчезает. Реакция нитрования по мере добавления воды замедляется, сохраняя первый порядок по субстрату.
В органических растворителях, таких как CCl4 , ацетонитрил, нитрометан, сульфолан, образование катиона NO2 + по уравнению (2) является стадией, определяющей скорость нитрования, вследствие чего реакция имеет нулевой порядок по ароматическому субстрату. Добавки веществ, влияющих на концентрацию NO2 + , сказываются на скорости нитрования. Так, введение нитратов или воды, подавляя ионизацию, замедляет нитрование.
В среде концентрированной серной кислоты равновесие целиком сдвинуто вправо (1). Исследование спектроскопическими (КР-, ИК-, УФ- спектроскопия), криоскопическим и кондуктометрическим методами привело к заключению, что полное превращение HNO3 в NO2 + сохраняется при снижении концентрации H2 SO4 до 90 %; при концентрации H2 SO4 82-70 % присутствуют только неионизированные молекулы HNO3 , при разбавлении H2 SO4 ниже 70 % появляются анионы NO3 - , а ниже 15 % присутствуют только ионы NO3 - . По данным спектров ЯМР 14 N, для 0,5 М раствора HNO3 степень превращения в NO2 + в среде 91,2 %-й H2 SO4 составляет 92 %, в 88,6 %-й – 54 %, в 86,2 %-й – 12 %, а в 81 %-й содержание NO2 + ниже предела чувствительности метода.
Нитрование ароматических углеводородов нитроний-катионом протекает как ионно-комплексная реакция. Сначала нитроний катион NO2 + присоединяется к ядру ароматического углеводорода,
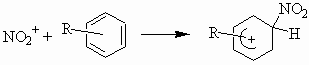
затем от образовавшегося соединения отрывается протон.
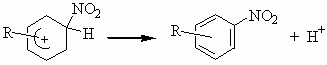
Более подробно этот процесс можно расписать через образование π- и σ- комплекса. Лимитирующей стадией является образование σ- комплекса, т.е. скорость процесса нитрования определяется скоростью присоединения нитроний-катиона к углеродному атому в молекуле ароматического углеводорода, так как протон отщепляется от этого углеродного атома почти мгновенно. Лишь в отдельных случаях нитрования в пространственно затрудненное положение отмечался значительный первичный кинетический изотопный эффект, обусловленный, очевидно, ускорением обратной реакции на стадии образования σ- комплекса из-за стерических препятствий и именно в таких случаях стадия образования σ- комплекса не является лимитирующей. К таким примерам относятся нитрование антрацена в положение 9 солями нитрония (KH /KD =6,1 в ацетонитриле, 2,6 в нитрометане), нитрование 1,3,5-три (трет-бутил)-2-R-бензолов азотной кислотой в серной кислоте (R=F, NO2 , CH3 , KH /KD =2,3-3,7). Но в большинстве случаев стадия образования σ- комплекса является определяющей для скорости процесса.
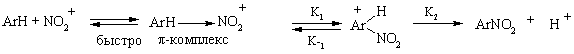
Поэтому уравнение скорости нитрования будет выглядеть так:
Wнитр = ![]()
K2 >> K1 и K-1 , так как отсутствует кинетический изотопный эффект и связывание протона не ускоряет реакцию. Величиной K-1 пренебрегают.
В концентрированной серной кислоте равновесие практически нацело сдвинуто вправо. Тогда кинетическое уравнение можно представить в следующем виде:
![]()
Как видно из уравнения, скорость реакции обратно пропорциональна концентрации воды и сульфат иона и прямо зависит от концентрации азотной кислоты. Это хорошо просматривается в условиях проведения реакции нитрования ряда ароматических соединений, содержащих электронодонорные или электроноакцепторные заместители (Таблица 1).
1.3. Фактор нитрующей активности
Нитрующая способность смеси серной и азотной кислот характеризуется фактором нитрующей активности (Ф.Н.А.):
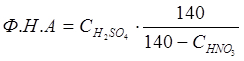
В этой формуле дробь характеризует степень возрастания концентрации серной кислоты после израсходования всей HNO3 и выделения соответсвующего коли-
Таблица 1.
Условия реакции нитрования некоторых ароматических соединений ArX
| Х | Избыток HNO3 (моль) | Состав нитрующей смеси, % | Температура, 0 С | ||
| HNO3 | H2 SO4 | H2 O | |||
| NHCOCH3 | 0 | 31 | 48 | 21 | 0 – 5 |
| CH3 | 0 | 24 | 59 | 17 | 40 |
| H | 0 | 20 | 65 | 15 | 40-60 |
| Cl | 0 | 18 | 71 | 11 | 60-80 |
| COOC2 H5 | 0,1 | 18 | 75 | 7 | 80-95 |
| NO2 | 0,1 | 18 | 80 | 2 | 90-100 |
| 1-CH3 ,2,4-ди-NO2 | 0,15 | 18 | 82 | 0 | 100-120 |