Реферат: Нитрование ароматических углеводородов. Производство нитро-бензола
где 18 и 63 – молекулярные массы воды и азотной кислоты.
Следовательно, Ф.Н.А. численно равен концентрации отработанной H2 SO4 при условии полного использования HNO3 . При этом Ф.Н.А., тем более высокое, чем ниже реакционная способность этого соединения. Для каждого процесса нитрования имеется предел Ф.Н.А., ниже которого нитрование практически не идёт. Когда азотная кислота почти полностью израсходована на нитрование, фактор нитрующей активности приближается к концентрации серной кислоты в отработанной смеси
Расход азотной кислоты на нитрование определяется стехиометрическими соотношениями; это количество несколько увеличивают с учётом побочных процессов окисления, потерь кислоты и др., а так же для интенсификации процесса и более полного превращения ароматического соединения. Необходимый избыток азотной кислоты сверх расчётного определяют для каждого нитруемого углеводорода опытным путём. Естественно, что степень использования азотной кислоты оказывается в таком случае ниже 100 %.
Количество вводимой серной кислоты определяется фактором нитрующей активности Ф.Н.А. В таблице 2 приведены показатели промышленных процессов нитрования некоторых ароматических углеводородов.
1.4. Механизм нитрования ароматических углеводородов
Процесс нитрования углеводородов смесью азотной и серной кислот протекает в гетерогенной среде, так как образуются две фазы – органическая (углеводородная) и кислотная. Благодаря частичной взаимно растворимости реагирующие компоненты распределяются между двумя фазами, и реакция протекает как в этих фа-
Таблица 2.
Показатели процессов нитрования некоторых ароматических углеводородов
| Исходный углеводород | нитросоединение | Ф.Н.А. | Расход HNO3 в % от теоретического |
| Бензол | мононитробензол | 70 | 103–105 |
| Мононитробензол | Динитробензол | 88 | 110-115 |
| Толуол | Мононитротолуол | 70 | 103-105 |
| Ксилол | Динитроксилол | 72 | 110-115 |
| Нафталин | Мононитронафталин | 61 | 103-105 |
| Мононитронафталин | Динитронафталин | 72 | 130-140 |
зах, так и на поверхности их раздела.
Легконитруемые углеводороды успевают прореагировать с ионом нитрония на поверхности раздела фаз; в этом случае существенное влияние на скорость реакции оказывает величина этой поверхности, которую можно значительно увеличить интенсивным перемешиванием. Для туднонитруемых углеводородов процесс не успевает пройти на поверхности раздела фаз, и реакция протекает в объёме той фазы, в которую проникают реагенты; для таких реакций поверхность раздела меньше влияет на степень превращения углеводорода и перемешивание способствует лишь насыщению одной фазы другой. Труднонитруемые вещества реагируют в основном в кислотном слое. В органический слой проникает главным образом азотная кислота, которая в отсутствие серной кислоты обладаем меньшей нитрующей способностью.
Стадия отрыва протона от σ- комплекса необратима, что делает необратимой реакцию в целом. Это объясняется сильным электроноакцепторным эффектом нитрогруппы, препятствующим протонированию по связанному с ней атому углерода. Однако если нитрогруппа занимает стерически затрудненное положение, при действии кислот может происходить денитрование, например в 9-нитроантрацене, 3,4,6-триизопропил-2-нитро-N-ацетиланилине или миграция нитрогруппы - например в 3-замещённых 2-нитрофенолах и в 3-замещённых 2-нитроанилинах. Миграция нитрогруппы в 3-R-2-нитроанилинах происходит из геминального узла в σ- комплексе (3), находящемся в равновесии с анилиниевым ионом (4)

(4) (3)
С использованием спектров ЯМР 15 N показано, что превращение 2,3-динитроанилина (5) в смесь 2,5- (6) и 3,4-динитроанилинов (7) (соотношение 2:1) в 98 %-й H2 SO4 при 110 o C не менее чем на 95 % протекает внутримолекулярно.

(5) (6) (7)
Константа скорости нитрования по мере увеличения кислотности возрастает, достигая максимума при концентрации H2 SO4 90 %, а затем снижается. Поскольку содержание ионов NO2 + при концентрации H2 SO4 > 90 % остаётся постоянным вследствие полного превращения азотной кислоты, снижение скорости в этом интервале относят к изменению главным образом коэффициента активности субстрата, возможно, в результате образования межмолекулярных водородных связей или протонирования. Для соединений, содержащих электроноакцепторные заместители, процесс протонирования цикла затруднен, так как электронная плотность на атомах углерода мала. При этом можно для увеличения концентрации катиона нитрония использовать концентрированную азотную кислоту и олеум.
![]()
Для получения полинитросоединений используют селитры в концентрированной серной кислоте:
![]()
При этом активность возрастает в следующем ряду: Х = H < NH4 < K < Na < Ag < Li. Так же нитраты калия или натрия в концентрированной серной кислоте, иногда применяемые в лабораторной практике, действуют аналогично азотной кислоте. Известно электрохимическое генерирование катионов нитрония анодным окислением нитрат-анионов в смеси азотной, серной кислот и воды (анодное нитрование):
-2e-
![]() NO3 - NO2 + +1/2O2
NO3 - NO2 + +1/2O2
Из других сильных кислот кроме серной для нитрования применяют фосфорную, хлорную, трифторуксусную, метан- и трифторметансульфокислоты.
Мощным нитрующим реагентом являются соли нитрония, которые могут быть приготовлены взаимодействием азотной кислоты с HF и кислотами Льюиса (BF3 , PF3 , SbF5 ). Соли нитрония в мягких условиях в среде полярных органических растворителей нитруют ароматические соединения с высокими выходами. Более селективный реагент – соли N-нитропиридиния, например:
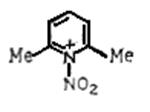
и N-нитрохинолиния, образующиеся при действии солей нитрония на соответствующие пиридины и хинолины. Этими реагентами можно нитровать в отсутствие кислот. Предполагают, что перенос нитрогруппы происходит путём атаки субстрата ониевой солью без предварительного гетеролиза в ней связи N-NO2 . Для высокоактивных легко окисляющихся соединений, таких как фенолы и нафтолы, переносчиком нитрогруппы может служить нитроциклогексадиенон, например:
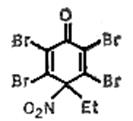
легко получаемый из соответствующего фенола и азотной кислоты.
Как уже говорилось ранее возможно проведение реакции нитрования и в азотной кислоте, в отсутствие серной кислоты. Преимуществом данного метода является то, что азотная кислота может быть регенерирована. При этом отпадает проблема утилизация разбавленной серной кислоты, азотная кислота возвращается в сферу производства. К существенным недостаткам метода относится необходимость использования коррозионностойкой аппаратуры (эмалированной или из нержавеющей стали), так как разбавленная кислота вызывает ее коррозию. При концентрации азотной кислоты 75 % и выше в растворе с помощью спектров комбинационного рассеяния обнаруживается нитроний-катион (в небольших концентрациях, около 2 %). Но даже в среде концентрированной серной кислоты не всегда достаточное генерирование ионов нитрония NO2 + .
Однако нитрование проводят азотной кислотой с концентрацией от 15% до 63%. В ряде случаев для успеха реакции требуется присутствие азотистой кислоты (соединений азота (III)). Например, нафталин-1,3,5-трисульфокислота, которую в промышленности гладко нитруют в положение 8 действием технической нитрующей смеси, остаётся неизменной в тех же условиях, если применяется чистая серная кислота и азотная кислота, не содержащая оксидов азота. Для нитрования нафталина азотной кислотой в 56 %-й H2 SO4 необходима добавка NaNO2 . При нитровании активированных ароматических соединений – N,N-диалкиланилинов, фенолов, анизола, мезитилена и др. -азотистая кислота оказывает каталитическое влияние.
При присутствие азотистой кислоты (или её солей) в азотной кислоте возможно изменение механизма реакции. На первой стадии в присутствии оксидов азота образуется нитрозосоединение, которое затем окисляется до нитропроизводного. В пользу этого свидетельствует увеличение выхода нитросоединения при добавке нитрита натрия. Вместе с тем немало фактов говорит и о том, что механизм реакции ион-радикальный или радикальный:
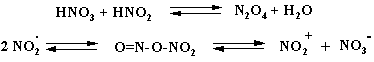
Нитрование бензола с помощью N2 O4 или 10 –20% азотной кислотой под давлением идет по радикальному механизму и приводит к получению сложной смеси, содержащей нитробензол, м- и п -динитробензолы, а также 1,3,5-тринитробензол и нитрофенолы. Жидкий N2 O4 (Ткип. 21о С) используют в качестве окислителя в жидкостных ракетах.
В связи с тем, что катион нитрония имеет малый радиус и высокий заряд, он является «жестким» реагентом и атакует ароматический цикл по положению с наибольшей электронной плотностью. При наличии электроноакцепторных групп в фенильном цикле наибольший отрицательный заряд локализован на атоме углерода в м- положении и углероде, связанном с этим заместителем. Существенно меньшая величина электронной плотности имеется в о- и п- положении кольца.
В результате реакции образуется смесь м-, о- и п- нитропроизводных, а также нитробензол.
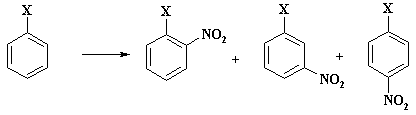
Выход изомерных нитросоединений (без учета образующегося нитробензола), приведен в таблице 3.
Таблица 3.
Выходынитропроизводных
| Изомеры | Заместители X, выход в % | ||||
| Орто- | 18,5 | 28,3 | 19 | 17,1 | 9 |
| Мета- | 80,5 | 68,4 | 72 | 80,7 | 90 |
| Пара- | 1 | 3,3 | 9 | 2,2 | 1 |
Высокий выход о- нитропроизводных при нитровании (так называемая «орто- ориентация») может быть объяснен ипсо- атакой катиона нитрония по атому углерода, связанному с электроноакцепторным заместителем, и последующим 1,2-сдвигом с получением «нормального» σ- комплекса.
Способность к ипсо- замещению используют в техническом органическом синтезе. При получении пикриновой кислоты для предотвращения окисления фенола азотной кислотой, ведущего к значительному осмолению реакционной массы, ароматическое ядро вначале дезактивируют с помощью введения электроноакцепторных сульфогрупп и только затем проводят нитрование:

На первой стадии образуется фенол-2,4-дисульфокислота, сульфогруппы в которой далее замещаются нитрогруппами и проходит нитрование в положение 6 цикла.
Синтез о - и п -нитрофенола, а также 2,4-динитрофенола осуществляют с помощью щелочного гидролиза соответствующих хлорбензолов. В последнее время разработан способ получения и пикриновой кислоты с помощью нитрования 2,4-динитрохлорбензола. Нитрование фенола не проводят, так как реакция идет очень энергично, а также в основном в связи с тем, что азотная кислота (особенно разбавленная) обладает высокой окисляющей способностью. Так, даже при нитровании бензола образуется примесь нитрофенолов за счет окисления азотной кислотой.