Реферат: Нитрование ароматических углеводородов. Производство нитро-бензола
Низкая региоселективность наблюдается при нитровании бензолсульфокислоты. Наряду с м -нитробензолсульфокислотой образуется до 15% о -изомера. Однако трудно объяснить наличие в реакционной массе нитробензола, т.к. концентрация отработанной серной кислоты составляет 93 – 95%, а в этих условиях процесс десульфирования маловероятен.
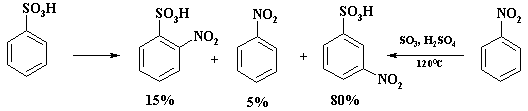
В промышленности м- нитробензолсульфокислоту получают сульфированием нитробензола, при этом образуется только один изомер.
Аномальные результаты реакции нитрования объясняются тем, что происходит «ипсо» -замещение с последующим 1,2-сдвигом:
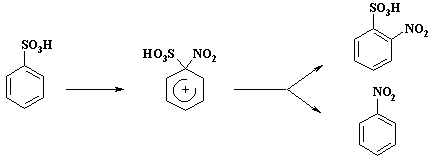
Катион нитрония атакует атом углерода связанный с сульфогруппой. Образующийся «аномальный» s-комплекс переходит в ароматическое состояние как за счет отщепления сульфогруппы, так и за счет смещения нитрогруппы к соседнему атому углерода (1,2-сдвиг) и отрыву протона от «нормального» s-комплекса.
Концепция ипсо- замещения и 1,2-сдвига разработана и подробно исследована в работах академика В.А. Коптюга. Показано, что при нитровании 2,3,5,6- тетраметиланизола терафторборатом нитрония при минус 800 С обнаружен s-комплекс с нитрогруппой в положении 3, повышение температуры до 00 приводит к 1,2-сдвигу:
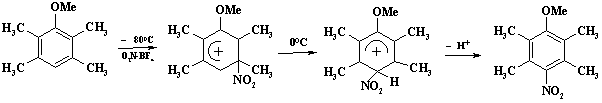
Образующийся «нормальный» s-комплекс теряет протон и превращается в 4-нитро-2,3,5,6-тетраметиланизол.
Для решения проблемы низкой селективности процесса проводят нитрование в среде уксусного ангидрида. При нитровании в уксусном ангидриде образуется ацетилнитрат, который в малой степени дает катион нитрония:
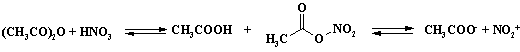
Ацетилнитрат пожаро- и взрывоопасен, применяют этот реагент в тех случаях, когда с помощью других методов не удается достичь нужного результата. В связи с низкой концентрацией электрофильного агента в растворе селективность процесса увеличивается. Пример сравнительной селективности при нитровании пара -хлортолуола (Таблица 4).
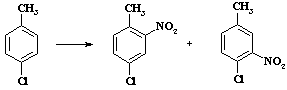
Таблица 4.
Региоселективность реакции нитрования
| Условия нитрования | Выход 2-нитро-4-хлортолуола (%) | Выход 3-нитро-4-хлортолуола (%) |
| HNO3 ; SO3 | 55 | 45 |
| H2 SO4 ; HNO3 | 65 | 35 |
| (CH3 CO)2 О; HNO3 | 87 | 13 |
2. Промышленное производство нитробензола
2.1. Общие сведения об нитробензоле
Нитробензол С6 H5 NO2 – жидкость жёлтого цвета с запахом горького миндаля (tкип =210,9 o C; tпл =5,7 o С; d4 20 =1,2). Слабо растворяется в воде, хорошо растворяется в эфире, спирте, бензоле и концентрированной азотной кислоте. В жидком виде нитробензол не обладает взрывчатыми свойствами; пары его при нагревании в закрытом сосуде могут разлагаться с большой скоростью.
Получение нитробензола является типичным процессом нитрования и для него характерны все технические аспекты это процесса. Производство может идти как по непрерывной схеме – для крупнотонажных производств (в нефтяной промышленности, анилинокрасочном производстве), так по периодической схеме – для малотоннажных (в фармацептической промышленности).
2.2. Процесс получения нитробензола
Получают нитробензол нитрованием бензола при 65-70 o C , а так же при температуре 40-50 o C. Нитрующую смесь готовят из меланжа и купоросного масла. Практически важным преимуществом нитрующих смесей и меланжа перед азотной кислотой является низкая коррозионная активность по отношению к железу. Полученная нитрующая смесь имеет следующий состав (в %):
HNO3 ……………….34
H2 SO4 …………..…54,5
H2 O………………11,5
В отработанной смеси кислот должно содержаться (в %)
HNO3 …………0,6 C6 H5 NO2 ………….0,5
H2 SO4 ……….72,5 H2 O………………26,2
NO2 ………………0,2
При нитровании бензола нитрующей смесью могут протекать как параллельные, так и последовательные реакции.
К параллельным относятся реакции окисления бензола. Замечено, что протеканию реакций окисления способствует наличие в нитрующей смеси окислов азота. Возможно, что образование кислородсодержащих соединений протекает с промежуточным нитрозированием углеводорода:
![]() С6 H6 + 2NO2 C6 H5 NO + HNO3 (1)
С6 H6 + 2NO2 C6 H5 NO + HNO3 (1)
![]() C6 H5 NO + 2NO C6 H5 -N=N-ONO2 (2)
C6 H5 NO + 2NO C6 H5 -N=N-ONO2 (2)
![]() C6 H5 –N=N-ONO2 + H2 O C6 H5 OH + HNO3 + N2 (3)
C6 H5 –N=N-ONO2 + H2 O C6 H5 OH + HNO3 + N2 (3)
![]() C6 H5 OH + HNO3 C6 H4 (OH)NO2 + H2 O (4)
C6 H5 OH + HNO3 C6 H4 (OH)NO2 + H2 O (4)
Образующийся по реакции (3) фенол нитруется со значительно большей скорость, а потому в условиях нитрования бензола фенол даёт моно-, ди- и даже тринитрофенол. Поэтому нитрующая смесь, которую применяют для нитрования бензола, не должна содержать оксидов азота.
На протекание окислительных процессов в значительной мере влияет температура нитрования: повышение температуры ускоряет образование оксосоединений.
Из последовательных реакций в основном протекает образование динитробензола. Наличие динитробензола в нитробензоле (более 0,3 %) создаёт опасность взрыва при дальнейшей переработке нитробезола в анилин парофазным способом; нежелательны примеси динитробензола и при других процессах переработки нитробензола (например, при получении бензидина).
Для уменьшения образования динитробензола необходимо не превышать установленного фактора нитрующей активности при нитровании бензола (Ф.Н.А. <= 70-72), поддерживать концентрацию азотной кислоты в отработанной кислоте менее 1 %, не хранить долго отработанную кислоту при температуре выше 30 o Cи не превышать температуру нитрования сверх установленной регламентом. Содержание динитробензола в товарном нитробензоле не должно превышать 0,1 %
Так как получения нитробензола является экзотермичной реакцией, как и большинство реакций нитрования. Тепловой эффект при введении нитрогруппы составляет 153 кДж/моль (36,6 ккал/моль). Кроме того, при нитровании выделяется вода, которая разбавляет серную кислоту. Этот процесс, как известно, также сопровождается выделением тепла.
К примеру, при проведении нитрования 320 кг хлорбензола (2.860 кг-моль) периодическим способом используют 1000 кг нитрующей смеси (11% H2 O, 18% HNO3 , 71% H2 SO4 ). Тепловой эффект разбавления серной кислоты составляет около 71250 ккал, нитрования 104571,4 ккал, итого выделится 175821,4 ккал. Так как скорость реакции высокая, выделяющееся тепло может резко повысить температуру реакционной массы.
Интенсивное выделение тепла во многом определяет технологию процесса нитрования бензола и его не возможно провод?