Реферат: Основные понятия координационной химии
Все теории катализа старались ответить на следующие вопросы:
1. Каким образом катализатор меняет реакционную способность реагентов, обеспечивая их превращение в нужном направлении?
2. Как найти катализатор для желаемой реакции?
Ответ на второй вопрос связан с ответом на первый. Современный взгляд на проблему активации имеет в основе химический подход, учитывающий особенности гетерогенного катализа: влияние носителя (коллективные свойства), особенности взаимодействия промежуточных соединений на поверхности гетерогенного катализатора, диффузия адсорбированных молекул в подповерхностные слои катализатора, изменение катализатора под воздействием реакционной среды (реагенты, продукты) и т. д..
Первым четко сформулировал идею «оптимального» взаимодействия между реагентами и катализатором Пьер Сабатье в кн. «Катализ в органической химии». Энергия образования интермедиата должна быть не слишком мала и не слишком велика. Если реакция образования интермедиата эндотермична, а энтропия понижается, то концентрация интермедиата будет очень мала, а следовательно, скорость стадии его превращения также будет низка. Если образование интермедиата будет очень выгодно, то его концентрация будет велика, скорость его дальнейшего превращения также будет низка, поскольку он очень прочный. И энергия активации стадии его превращения будет велика.
Т.к. любой интермедиат в каталитическом процессе – это частица, где субстрат связан с металлом-катализатором, то фактически мы имеем дело координационным соединением (или частью его). Такому соединению присущи все основные свойства, характеризующие обычные координационные соединения. И поэтому о прочности связи Кт-субстрат, и об активации субстрата можно судить с тех же позиций, которые применимы в координационной химии для связи металл-лиганд, для характеристики изменений лиганда (т.е. его активации).
Координационная связь (связь металл-лиганд).
В “классической” химической связи каждый из двух атомов, участвующих в ее образовании, вносит в ее создание 1 электрон. Координационная связь характеризуется тем, что оба электрона поставляются одним из партнеров. Партнер, поставляющий электроны, называется донором, а принимающий электроны – акцептором. Связывающая и антисвязывающая МО образуются из заполненной орбитали одного и вакантной орбитали другого партнера. Связывающая МО принимает два электрона, а антисвязывающая остается пустой. Образуется молекула, так как эта ситуация является энергетически более выгодной, чем когда два электрона находятся на изолированной орбитали донора (связывающая МО всегда энергетически ниже, чем любая из ее составляющих орбиталей). Центральный атом переходного металла может так же, как лиганды, действовать в качестве донора. Поэтому в качестве валентных орбиталей необходимо рассматривать не только верхние занятые орбитали металла и лигандов, но также низлежащие свободные орбитали. Для атома переходного металла должны приниматься в расчет (n-1)d-, ns- и np-орбитали.
Рассмотрим октаэдрический комплекс [Co(NH3 )6 ]3+ . Лиганд – молекула аммиака – имеет три стабильные N-H молекулярные σ-орбитали (МО), которые имеют слишком низкую энергию, чтобы принимать участие в связи с металлом; для связывания пригодна орбиталь неподеленной пары электронов на атоме азота.
Рис. 6.12. стр. 134.
Из 6 d-орбиталей металла (в октаэдрическом комплексе) только одна имеет электронную плотность, направленную таким же образом, что и электронная плотность неподеленной электронной пары лиганда. Следовательно, если d-орбиталь свободна, то может образоваться σ-связь (орбиталь неподеленной пары поставляет два электрона).
Рис. 6.13 (а), стр. 135
Разобрать: связь металл-СО
Рис. 6.13 (б), стр. 135
Итак, в координационной химии мы имеем дело с металлом-комплексообразователем (или группой металлов – это уже кластерная химия). Атомы, окружающие металл-комплексообразователь, называются лигандами. Лиганды образуют внутреннюю координационную сферу.
Центральный атом и окружающие его лиганды называются комплексом. Важно: комплексы не теряют своих свойств при переходе из одной фазы в другую, например, при растворении соединения внутренняя координационная сфера остается без изменений.
Классификация комплексов
Основные понятия и определения.
Комплексы могут быть моноядерными (в составе комплекса – один атом металла-комплексообразователя) и полиядерными (в составе комплекса несколько атомов металла-комплексоообразователя). Если в полиядерных комплексах атомы металла-комплексообразователя связаны прямым взаимодействием металл-металл, то такие комплексы называются кластерными.
Моноядерный комплекс – K2 PdCl4
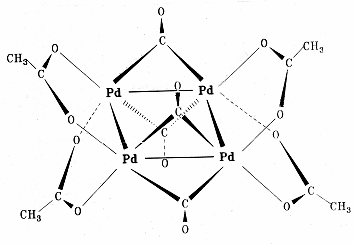
Полиядерный комплекс - [Pd(CH3 COO)2 ]3
Кластерный комплекс Pt4 (OCOCH3 )8 :
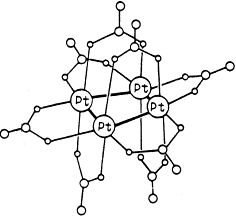
Комплексы могут быть нейтральными, катионными и анионными.
Нейтральными называются такие комплексы, в которых металл-комплексообразователь и лиганды образуют молекулу целиком.
Примеры: моноядерные: Ni(CO)4 , Ni(C2 H4 )(PPh3 )2

Полиядерные: Pt4 (OCOCH3 )8 ,
Катионными называются такие комплексы, в которых металл-комплексообразователь входит в состав катиона.
Примеры: моноядерные: [Co(NH3 )6 ]Cl3
--> ЧИТАТЬ ПОЛНОСТЬЮ <--