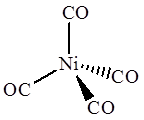Реферат: Основные понятия координационной химии
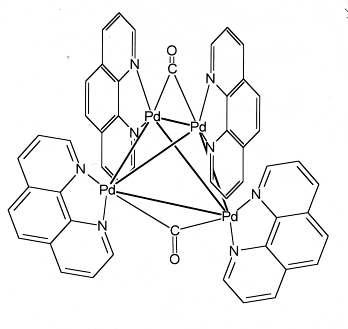
Анионными называются такие комплексы, в которых металл-комплексообразователь входит в состав аниона.
Примеры: K2 PdCl4 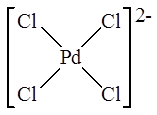 ,
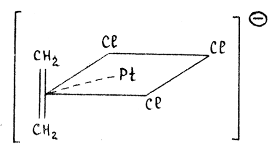
,
соль Цейзе
ФСО
ФСО в комплексном соединении определяется как средний заряд атомов металла, который они имеют после удаления лигандов.
В классической координационной химии принимается, что у уходящих лигандов (например, таких, как H- , Cl- , O2- , OH- , NH2- , NR2 - , NR2- и т.д.) электронная оболочка атома, связанного с металлом, соответствует оболочке атома ближайшего инертного газа. Лиганды CO, N2 , CO2 , C2 H2 , C2 H4 , PR3 и т.д. удаляются в виде нейтральных молекул. Поэтому для определения ФСО металла в комплексном соединении в первую очередь обращают внимание на заряд лигандов. Так, в карбонилфосфиновых кластерах палладия, имеющих состав Pdx (CO)y (PR3 )z (к этой группе относятся кластеры, различающиеся ядерностью и строением металлоостова, например Pd7 (μ3 -CO)4 (μ-CO)3 (PMe3 )7 ,Pd10 (CO)12 (PBu3 )6 , Pd16 (CO)13 (PEt3 )6 ,Pd59 (CO)32 (PMe3 )21 ,Pd69 (CO)36 (PEt3 )18 ) и карбонильные, и фосфиновые лиганды нейтральны, поэтому все атомы палладия в этих соединениях имеют одинаковую ФСО – ноль. Другой пример: катионный кластер [Pd4 (CO)2 (Phen)4 ]4+ , где
Phen = 1,10-фенантролин (нейтральный лиганд) и СО – тоже нейтральный лиганд. Здесь на 4 атома палладия приходится 4 положительных заряда, т.е. ФСО палладия равна (+1).
Разные виды классификации:
Классификация комплексов по химической специфике лигандов.
1. Атомы элементов в качестве лигандов (H, O, N, C, S, Se, F, Cl и др.). Некоторые из них – координируются в виде одно- или двухзарядных анионов, другие не существуют в индивидуальном состоянии в мягких условиях (N, O, S).
ПРИМЕРЫ КОМПЛЕКСОВ
А) гидридные комплексы (например, гидриды рения). В комплексе рения K2 ReH9 шесть атомов водорода находятся в вершинах тригональной призмы, а три атома водорода образуют правильный треугольник, лежащий на одинаковых расстояниях от обоих оснований призмы. Металл-комплексообразователь находится в центре эого треугольника.

Строение аниона [ReH9 ]2-
б) галогенидные комплексы:
Например, соединение K2 PdCl4 является анионным комплексом и содержит тетрахлоропалладат-анион (PdCl4 )2- (см. рис. выше).
В) Халькогенидные комплексы, т.е. содержащие серу, селен, теллур, связанные с центральным атомом. Примеры:
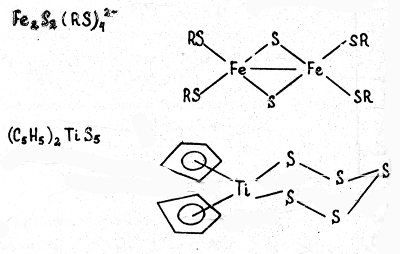
Как правило, комплексы содержат лиганды разного типа или лиганды, состоящие из разных атомов. Например, карбонилгидридные комплексы содержат одновременно и карбонильные (СО), и гидридные (Н- ) лиганды, как это видно на примере карбонилгидридов хрома [(CO)5 Cr]2 (μ-H) или рения (CO)3 Re(μ-H)3 Re(CO)3 .

В связи с вышесказанным такая классификация употребима главным образом для галогенидных или халькогенидных комплексов.
2. В качестве лигандов часто выступают отрицательно заряженные группы атомов – анионные лиганды –
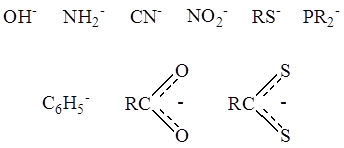
Примером может служить кластерный комплекс платины состава Pt4 (OCOCH3 )8 :
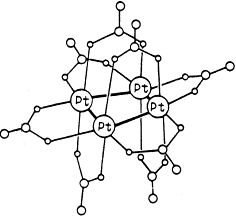
В кластере четыре атома платины образуют квадрат с коротким расстоянием металл-металл. По каждой стороне квадрата координированы по две мостиковых ацетатных группы. В координации каждой ацетатной группы участвуют в одинаковой мере оба карбоксилатных атома кислорода, поставляя для образования донорно-акцепторной связи пару электронов с каждого атома кислорода, а еще один электрон делокализован между этими двумя атомами кислорода.
3. Лигандами могут быть устойчивые двухатомные и многоатомные молекулы:
N2 , O2 , CO, NO, NH3 , NR3 , H2 O, R2 O, SO2 , CS2 , PR3 , RCN, C6 H6
ПРИМЕРЫ: