Реферат: Основные понятия координационной химии
В тетракарбониле никеля Ni(CO)4 атом металла помещен в центр тетраэдра, образуемого 4 атомами углерода карбонильных групп, поэтому комплекс имеет тетраэдрическое строение. В биядерном дикобальтоктакарбониле Co2 (CO)8 каждый атом кобальта имеет квадратно-пирамидальное окружение, причем основание квадратной пирамиды образуют 4 атома углерода карбонильных групп, а вершину этой пирамиды – второй атом кобальта.
В сэндвичевых соединениях – дибензолхроме (C6 H6 )2 Cr и ферроцене (C5 H5 )2 Fe атом металла располагается между двумя плоскими ароматическими молекулами, каждая из которых связана с атомом металла по π-типу:


4. Лигандами могут служить молекулы или фрагменты молекул, которые не существуют в свободном состоянии или являются чрезвычайно неустойчивыми (карбены, карбины, нитрены и т.д.)
Карбеновые комплексы:

Карбиновые комплексы

Нитреновые комплексы – это фактически азотсодержащие аналоги карбенов, где нитреновый лиганнд связывается с центральным атомом за счет кратной связи металл-азот, как, например, в комплексе рения:
![]()
Классификация комплексов по специфике электронной конфигурации лигандов.
Этот тип классификации уже в какой-то мере отражает особенности химической связи металл-лиганд.
1. σ-лиганды – лиганды с одной или несколькими неподеленными парами электронов, локализованными на одном донорном атоме. Эти лиганды при взаимодействии с металлами образуют σ-комплексы. Их можно разделить на две группы:
а) лиганды, имеющие одну или несколько неподеленных σ-пар электронов и не имеющие энергетически доступных вакантных орбиталей – F- , H2 O, ROH, NH3 , H- ,
2. π-лиганды – лиганды, донорные пары которых делокализованы на двух или более центрах и являются π-электронными парами. К таким лигандам относятся производные этилена, диенов, ацетилена, бензола и других ациклических и циклических ненасыщенных соединений.
ПРИМЕРЫ
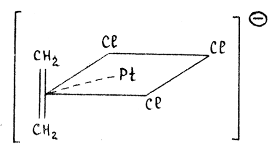
Так, например, в анионе соли K[PtCl3 (C2 H4 )] атом платины имеет плоско-квадратное окружение, в котором π-координированная молекула этилена занимает одно координационное место:
Или, например, в биc-π-аллильном комплексе никеля (см. рис.) каждый аллильный лиганд занимает 3 места в координационной сфере металла

Некоторые лиганды могут выступать в роли и σ-. и π-лигандов.
Это лиганды, имеющие вакантные σ- или π-орбитали – Br- , I- , PR3 , R2 S, SnCl3 - . NO, CO, карбены, нитрены.
Так, например, монооксид углерода, который будет подробней рассмотрен ниже, является одновременно лигандом с σ-донорными и π-акцепторными свойствами, причем в разных соединениях, в зависимости от природы металла-комплексоообразователя, от его заряда, от влияния других лигандов, преобладают либо одни, либо другие свойства.
