Реферат: Создание эффективной химико-технологической схемы ХТС производства алюминия
Полученный по методу Байера глинозем представляет смесь ![]() -модификации (корунд) и
-модификации (корунд) и ![]() -модификации оксида алюминия. Технический продукт представляет белое кристаллическое вещество и выпускается нескольких марок, различающихся чистотой. Наиболее вредными примесями в глиноземе являются оксид кремния, оксид железа (III) и оксид титана (IV).
-модификации оксида алюминия. Технический продукт представляет белое кристаллическое вещество и выпускается нескольких марок, различающихся чистотой. Наиболее вредными примесями в глиноземе являются оксид кремния, оксид железа (III) и оксид титана (IV).
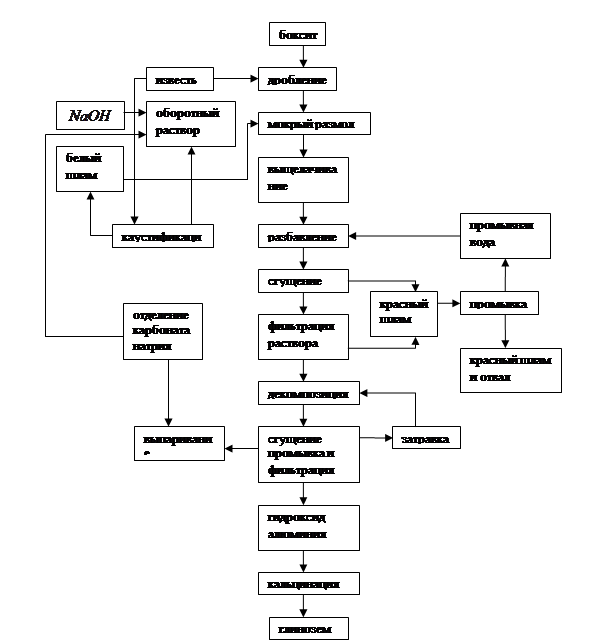
Рис. 4.2. Принципиальная схема производства глинозема по методу Байера
Из принципиальной схемы процесса следует, что в методе выщелачивания Байера осуществляется замкнутый технологический цикл щелочи. Щелочь, затраченная на выщелачивание оксида алюминия из боксита, регенерируется на стадиях декомпозиции и каустификации и возвращается в процесс на обработку новых порций боксита. Таким образом, в методе Байера реализуется принцип организации малоотходного производства.
1.4 ЭЛЕКТРОЛИТИЧЕСКОЕ ПРОИЗВОДСТВО АЛЮМИНИЯ
Единственным промышленным методом получения металлического алюминия из его оксида является электролиз его расплава.
Температура плавления чистого оксида алюминия в его ![]() -модификации, устойчивой выше 900°С, равна 2053°С. Электролиз его расплава связан с весьма высоким расходом электроэнергии на расплавление и поддержание высокой температуры ванны и приводит к низкому выходу по энергии. Поэтому в производстве алюминия применяют не чистый оксид алюминия, а систему, состоящую из оксида алюминия и криолита
-модификации, устойчивой выше 900°С, равна 2053°С. Электролиз его расплава связан с весьма высоким расходом электроэнергии на расплавление и поддержание высокой температуры ванны и приводит к низкому выходу по энергии. Поэтому в производстве алюминия применяют не чистый оксид алюминия, а систему, состоящую из оксида алюминия и криолита ![]() , то есть криолит-глиноземный расплав.
, то есть криолит-глиноземный расплав.
Криолит плавится при 1100°С. Он образует с оксидом алюминия при содержании последнего около 15% мас. эвтектику с температурой плавления 938°С. Дальнейшее увеличение содержания глинозема в расплаве приводит к резкому повышению температуры плавления системы.
Для снижения температуры плавления электролита, увеличения его электропроводности, улучшения смачиваемости им анода в расплав вводятся добавки фторидов алюминия, магния, лития и кальция. Промышленный электролит имеет![]() состав:
состав:
![]()
![]() 2-4%,
2-4%,![]() .
.
В результате диссоциации основных компонентов системы
![]()
и ![]()
а также добавок фтористых солей, расплавленный электролит представляет сложную многокомпонентную систему, содержащую ионы:
![]() .
.
Таблица 4.1. Первичные процессы при электролизе
| Электрод | Потенциал разряда, В | Первичная реакция |
| Катод |
+2,71 +1,66 |
|
| Анод |
более -0,5 -0,47 |
|
Следовательно, при электролизе криолитоглиноземного расплава разряжаются ионы ![]() .
.
Вторичные процессы при электролизе криолитоглиноземного расплава протекают как в анодном, так и в катодном пространствах.
В анодном пространстве при температуре электролиза происходит непрерывное окисление угольных анодов с образованием смеси оксида углерода (II) и оксида углерода (IV):
![]()
Суммируя реакции первичных и вторичных процессов, получаем суммарные уравнения реакций электролиза: