Реферат: Технічна термодинаміка та теплові процеси технології будівельних матеріалів
Абсолютний тиск в котлі
Рабс = 40000 + 96660 = 136660 Па.
Надлишковий тиск
Рнад = 136660 - 104660 = 0,032 МПа.
1.2 Рівняння стану
Якщо температура газу є сталою (T-const), то згідно закону Бойля-Маріотта РV = const.
Якщо тиск газу є сталим (Р = const), згідно закону Гей-Люссана ![]() або
або ![]()
Для газів, які мають однакову температуру і тиск, на основі закону Авогардо ![]() (тут М - молекулярна маса газу), або MV = const.
(тут М - молекулярна маса газу), або MV = const.
Нормальні умови відповідають тиску Р = 101325 Па, Т = 273,15 К (760 мм рт. ст., 00 С). Об’єм 1 кмоля ідеальних газів = 22,4136![]() . Звідси
. Звідси ![]() н = М/22,4, кг/м3 , а
н = М/22,4, кг/м3 , а ![]() = 22,4/М, м3 /кг.
= 22,4/М, м3 /кг.
Характеристичне рівняння ідеального газу:
![]() , або PV = MRT (1.2)
, або PV = MRT (1.2)
Де R - газова стала, V - об’єм, M - маса газу.
Газовастала відносно 1 кг газу складає: ![]() . Дж ⁄ (кг/∙K)
. Дж ⁄ (кг/∙K)
Виходячи із характеристичного рівняння дійсним є
![]()
Приклад 1-3. Тиск газу за показанням манометра складає 0,3 МПа при температурі 60 0 С, об’єм газу 2,5 м3 . Визначити об’єм газу для нормальних умов.
Виходячи із рівняння ![]() визначаємо V0 :
визначаємо V0 :
![]() ,
,
Р0 = 760 мм рт. ст. (0,101МПа). Рнад = 0,3 + 0,101 = 0,401 МПа.
![]() нм3
нм3
Іноді технічні розрахунки спрощують, якщо тиск газу мало відрізняється від атмосферного:
V0 = V![]() .
.
Приклад 1-4. Суміш газів має об'ємний склад (%): СО2 - 12, N2 - 74, H2 O - 6, О2 - 7, СО - 1. Тиск суміші 0,1 МПа (750 мм рт. ст) Визначити молекулярну масу, газову сталу, густину суміші при температурі 10000 С і парціальний тиск окремих газів.
1) 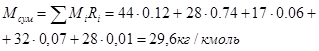
2) ![]()
3) із рівняння стану для 1 кг газу
Pv = RT, або ![]() звідси
звідси ![]()
![]()
![]()
4) Рі = Р∙аі (тут аі - об'ємна частка газу)
Р CO2 = 0.1∙0.12 = 0.012 МПа = 12 кПа,
Р N2 = 0.1∙0.74 = 0.074 МПа = 74 кПа,