Реферат: Теплоёмкость. Термодинамические процессы с идеальным газом
Отношение теплоты δq, полученной единицей количества вещества к изменению температуры dt называют удельной теплоемкостью.
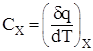 (1.1)
(1.1)
Поскольку количество теплоты δq зависит от характера процесса, то и теплоемкость системы CX также зависит от условий протекания процесса.
Теплоемкость в зависимости от количества вещества может быть массовой – С, объемной – С' и мольной µC. Связь между ними:
![]() (1.2)
(1.2)
Физический смысл теплоемкостей идеального вещества при V = const и P = const следует из рассмотрения дифференциальных соотношений термодинамики вида:
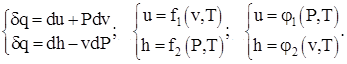 (1.3)
(1.3)
После соответствующих преобразований с учётом свойств идеального газа получим:
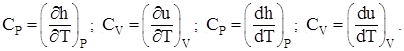 (1.4)
(1.4)
Это свидетельствует о том, что изменения внутренней энергии и энтальпии определяются как:
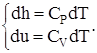 (1.5)
(1.5)
т.е. независимо от характера процесса.
Соотношения между CP и CV:
![]() (1.6)
(1.6)
В соответствии с молекулярно-кинетической теорией газов мольная теплоемкость при V = Const пропорциональна числу их степеней свободы, выраженному в джоулевом эквиваленте и для одного моля газа равна µСV = 3 × 4,19 = 12,5 Дж/(моль×К). Тогда в соответствии с законом Майера, µСP = 5 × 4,19 = 20,8 Дж/(моль×К), что позволяет в зависимости от атомности газа и их степеней свободы представить значения мольных теплоёмкостей в следующем виде:
Таблица № 1.1.
| Атомность газа | μCV | μCP | ||
| Дж/(моль×К) | кал/(моль×К) | Дж/(моль×К) | кал/(моль×К) | |
| одноатомный | 12,5 | 3 | 20,8 | 5 |
| двухатомный | 20,8 | 5 | 29,1 | 7 |
| трёх - и более атомный | 29,1 | 7 | 37,4 | 9 |
Теплоемкость, определяемая по уравнению (4.1) при заданных параметрах состояния (P, v, Т) называемая истинной и может быть выражена как:
CX = CX0 + ΔCX,(1.7)
где СX0 – теплоемкость газа в разряженном состоянии (при P " 0) и зависит только от температуры, а ΔСX – определяет зависимость теплоемкости от давления и объема.
Средняя теплоемкость СXm в интервале температур от T1 до T2 выражается как:
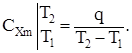 (1.8)
(1.8)
Если принять что один из пределов, например T1 = 273,15 К, то можно рассчитать средние теплоемкости газов в интервале температур от t1 = 0 °C до t2 = х °C и представить их значения в табличной форме, см. приложение, таблицы №2 – №4.
Количество теплоты, передаваемое системе согласно уравнению (4.8) и используя данные теплоемкостей, таблицы №2 – №4, с учетом (4.2), в зависимости от процесса рассчитывается по формулам:
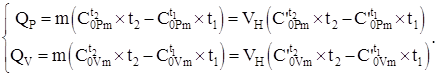 (1.9)
(1.9)
Для приближенных расчетов количества теплоты при не очень высоких температурах можно принять C = Const и тогда уравнения (1.14) с учетом (1.2) – (1.4) и значений таблицы №4.1. будут иметь вид:
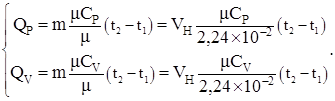 (1.15)
(1.15)
Задачи для самостоятельного решения.
Задача № 1-1. Воздух имеющий объем V = 15 м3 при температуре t1 = = 1500 °C и давлении Р = 760 ммHg, охлаждается изобарически до температуры t2 = 250 °C. Определить отводимое тепло QP, если: а) считать теплоемкость постоянной, б) использовать формулу µСP = 6,949 + + 0,000576×t.
Задача № 1-2. Расход воздуха измеряется с помощью электрического нагревателя, установленного в воздухопроводе. Температура воздуха перед нагревателем и за ним измеряется с помощью двух термометров. Определить часовой расход воздуха G кг/ч, если при включении электрического нагревателя мощностью 0,75 кВт температура воздуха перед нагревателем Т1 = 288 К, а за нагревателем Т2 = 291,1 К. Определить также скорость потока воздуха за нагревателем, если давление его (принимаемое нами неизменным) Р = 870 ммHg, а диаметр воздухопровода d = 90 мм.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--