Реферат: Термодинамические характеристики расплавов на основе железа
Согласно второму закону термодинамики, энергия Гиббса при необратимых процессах может только убывать. Отсюда следует, что ![]() является критерием направления и полноты протекания реакции между веществами, взятыми в стандартном состоянии. Реакция может протекать только в том направлении, которое характеризуется отрицательным значением
является критерием направления и полноты протекания реакции между веществами, взятыми в стандартном состоянии. Реакция может протекать только в том направлении, которое характеризуется отрицательным значением ![]() , т.е. реакция всегда идет в направлении снижения энергии Гиббса системы. Если
, т.е. реакция всегда идет в направлении снижения энергии Гиббса системы. Если ![]() , то это указывает на равновесие между реагентами в их стандартных состояниях (реакция не идет). Полнота протекания реакции характеризуется константой равновесия К, связанной с
, то это указывает на равновесие между реагентами в их стандартных состояниях (реакция не идет). Полнота протекания реакции характеризуется константой равновесия К, связанной с ![]() уравнением изотермы:
уравнением изотермы: ![]() .
.
Поскольку R=8,3192 Дж/(моль*К): ![]() .
.
При переходе к десятичным логарифмам получаем: ![]() .
.
Пользуясь этим уравнением, можно по известному значению ![]() определить константу равновесия реакции, и найти необходимые для практики равновесные концентрации и другие характеристики. Например, для реакции получения TiC (
определить константу равновесия реакции, и найти необходимые для практики равновесные концентрации и другие характеристики. Например, для реакции получения TiC (![]() ), исходя из последнего уравнения и температурной зависимости
), исходя из последнего уравнения и температурной зависимости ![]() , можно получить следующее выражение для константы равновесия:
, можно получить следующее выражение для константы равновесия:
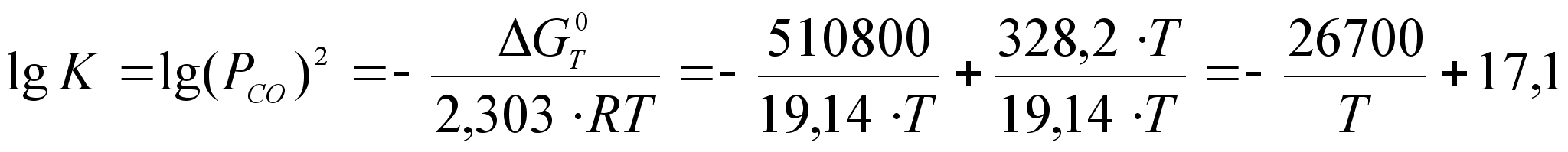
(15)
1.1.4 Экстенсивные, интенсивные свойства; парциальные величины.
Э
(16)
???????????? ???????? ????????, ??????? ??????? ?? ?????????? ???????? : V, H, S, G ? ?.?. ??? ??????????? ????????????? ???????? g ???????? ?????????? ?????????????? ??????????? (??????????? ???????) ?????????????? ???????????
Интенсивные свойства раствора – свойства, не зависящие от количества вещества, такие, например, как температура, давление. К числу интенсивных принадлежат и парциальные мольные характеристики ![]() . Интенсивные свойства представляют собой частные производные от соответствующих экстенсивных свойств раствора по числу молей данного компонента при постоянных температуре, давлении и числах молей других компонентов:
. Интенсивные свойства представляют собой частные производные от соответствующих экстенсивных свойств раствора по числу молей данного компонента при постоянных температуре, давлении и числах молей других компонентов:
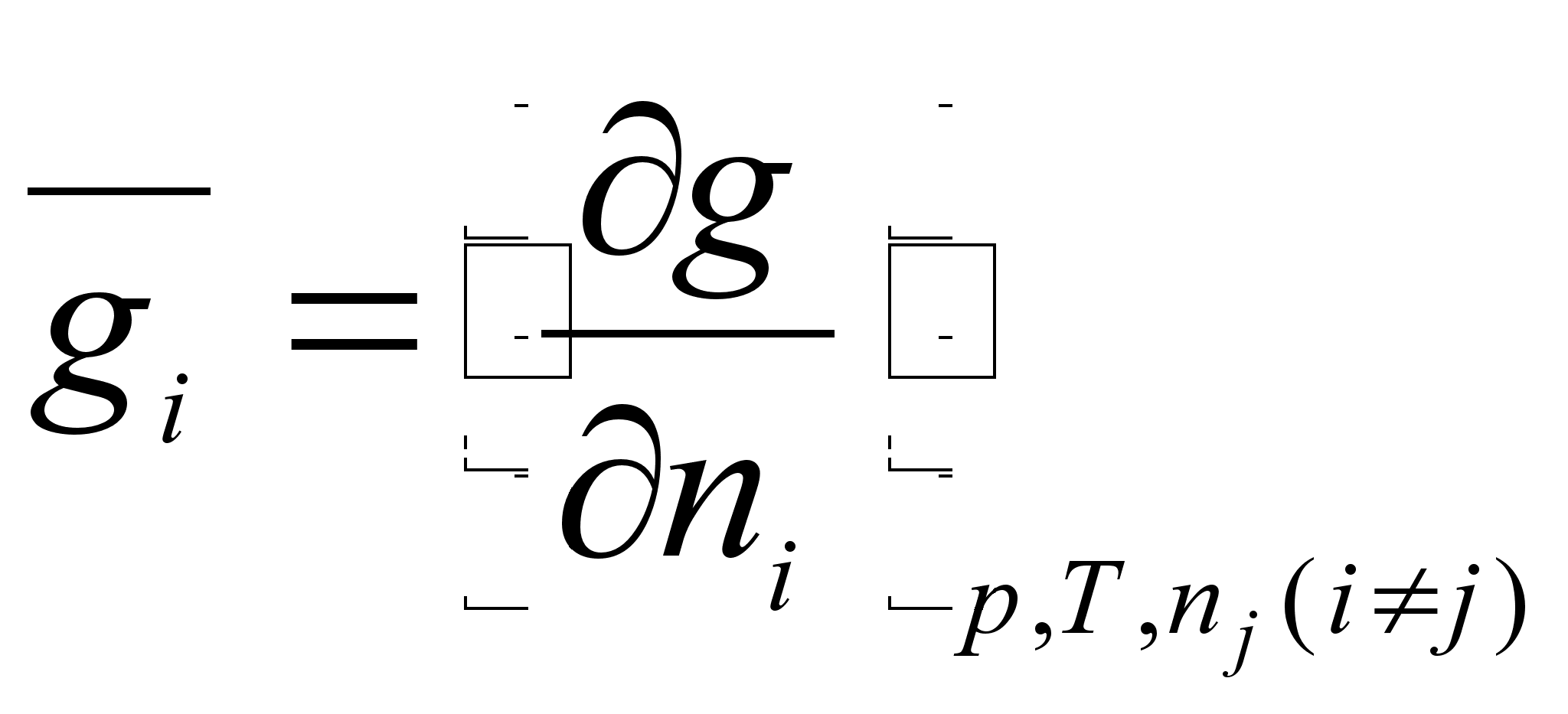
(17)
.
Таким образом, ![]() представляет собой приращение свойства бесконечно большого количества раствора при добавлении 1 моля i-того компонента. Например, парциальный мольный объём компонента в растворе заданного состава показывает, на какую величину изменится объём этого раствора (взятого в бесконечно большом количестве) при добавлении 1 моля данного компонента. [6]
представляет собой приращение свойства бесконечно большого количества раствора при добавлении 1 моля i-того компонента. Например, парциальный мольный объём компонента в растворе заданного состава показывает, на какую величину изменится объём этого раствора (взятого в бесконечно большом количестве) при добавлении 1 моля данного компонента. [6]
1.2 Растворы
Раствором называется однородная смесь, состоящая из двух или большего числа веществ, состав которой в известных пределах может непрерывно изменяться.
Однородными являются и химические соединения, однако их состав не может изменяться непрерывно, так как они подчиняются законам постоянства состава и кратных отношений.
1.2.1 Идеальные растворы
Цель термодинамической теории расплавов состоит в том, чтобы связать различные свойства растворов и найти способы предсказания свойств растворов, исходя из свойств чистых компонентов. Ввиду очень сложного характера взаимодействия компонентов в растворах решение этой задачи в общем виде невозможно. Поэтому целесообразно сначала рассмотреть идеализированные случаи, в которых можно отделить главные черты явления от второстепенных. [1]
Раствор называется идеальным, если :
а) теплота смешения равна нулю ![]() ,
,![]()
б) изменение объема при смешении чистых компонентов равно нулю
![]() ,
,
в) парциальное давление пара каждого компонента пропорционально его молярной доле. Это означает, при всех концентрациях соблюдается закон Рауля при условии, что пары следуют законам идеальных газов и, следовательно, парциальные давления равны летучим. [7]
Идеальным называется раствор, в котором соблюдается закон Рауля при температурах и давлениях, при которых возможно его существование. Закон Рауля гласит, что для ограниченного числа растворов парциальное давление каждого компонента pi равно произведению молярной доли компонента xi на упругость пара в его чистом виде (давление пара чистого компонента)![]() : [2]
: [2]
![]()
(18)
Теплота образования идеального раствора. Поскольку, суммарная энергия взаимодействия частиц при образовании идеального раствора из чистых компонентов не изменяется (такие растворы называют совершенными), парциальные объемы компонентов и их парциальные энтальпии будут равны соответствующим мольным характеристикам: ![]() . [6] Таким образом, теплота испарения компонента в идеальном растворе равна теплоте испарения его в чистом виде. [2] В этом случае энтальпия раствора аддитивно складываются из мольных величин:
. [6] Таким образом, теплота испарения компонента в идеальном растворе равна теплоте испарения его в чистом виде. [2] В этом случае энтальпия раствора аддитивно складываются из мольных величин:
![]()
(19)