Реферат: Термодинамические характеристики расплавов на основе железа
где z – число ближайших соседей атома;
NA – число Авогадро;
![]() - энергия образования двух связей между разноименными атомами:
- энергия образования двух связей между разноименными атомами:
![]()
(61)
Р
(62)
1-2 ? ????? ?????? 1-2; ??? ??????????? ???????????? ??????:Р1-2=z NA x1x2 .
Р
(63)
????????? ???????????????? ??????????? ????????
![]() ,
,
что соответствует параболе с экстремумом в точке х1=х2=0,5. Экспериментальное значение ![]() в этой точке равно
в этой точке равно ![]() . Для определения парциальных энтальпий компонентов
. Для определения парциальных энтальпий компонентов ![]() и
и ![]() необходимо продифференцировать данное уравнение, переписав его для раствора, содержащего n1+ n2 молей компонентов, следующим образом:
необходимо продифференцировать данное уравнение, переписав его для раствора, содержащего n1+ n2 молей компонентов, следующим образом:
![]()
(64)
.Отсюда получим:
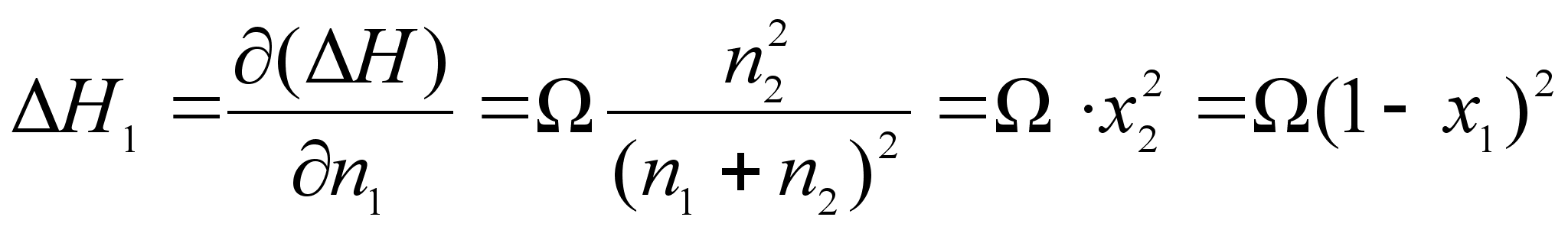
(65)
(66)
,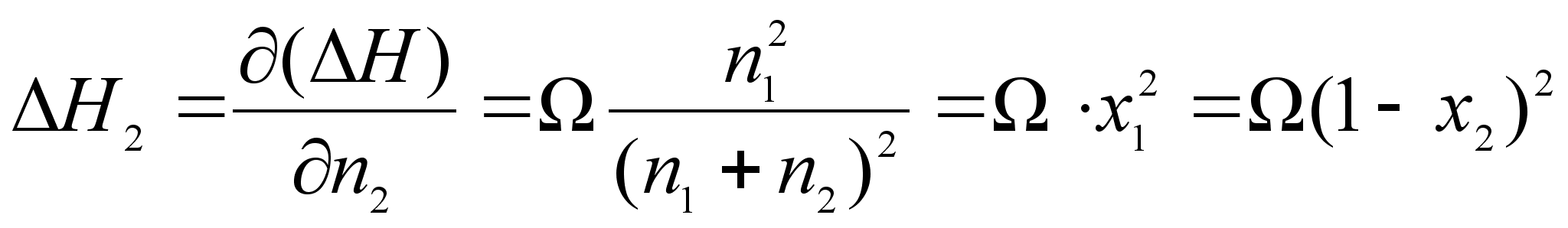 .
.
Как видно из уравнений, энергия смешения ![]() равна предельному значению
равна предельному значению ![]() (при
(при ![]() ). Учитывая связь между теплотой растворения и коэффициентом активности, можно получить следующее выражение для зависимости коэффициентов активности от концентрации:
). Учитывая связь между теплотой растворения и коэффициентом активности, можно получить следующее выражение для зависимости коэффициентов активности от концентрации:
![]()
(67)
;
(68)
Из данных уравнений следует, что при ![]() коэффициент
коэффициент ![]() стремится к
стремится к ![]() , а
, а ![]() . Таким образом, в теории регулярных растворов возможно только приближенное выполнение законов Генри (
. Таким образом, в теории регулярных растворов возможно только приближенное выполнение законов Генри (![]() ) и Рауля(
) и Рауля(![]() ) в области малых значений х2 отличных от нуля.
) в области малых значений х2 отличных от нуля.
Таким образом, энергия Гиббса (для бинарного раствора):
![]()
(68)
;
![]()
(68)
;