Реферат: Термодинамические потенциалы
![]() Из последнего равенства понятно, почему энтальпию еще называют теплосодержанием. При горении и других химических реакциях, происходящих при постоянном давлении (
Из последнего равенства понятно, почему энтальпию еще называют теплосодержанием. При горении и других химических реакциях, происходящих при постоянном давлении (![]() ), выделяемое количество теплоты равно изменению энтальпии.
), выделяемое количество теплоты равно изменению энтальпии.
Выражение (3.11), с учетом второго начала термодинамики (2.7) позволяет определить теплоемкость:
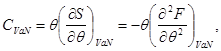
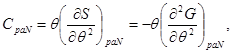
(3.12)
![]()
Все термодинамические потенциалы типа энергии обладают свойством аддитивности. Поэтому можно записать:
![]()
![]() (3.13)
(3.13)
![]()
Легко видеть, что потенциал Гиббса содержит только один аддитивный параметр ![]() , т.е. удельный потенциал Гиббса
, т.е. удельный потенциал Гиббса ![]() от
от![]() не зависит. Тогда из (3.4) следует:
не зависит. Тогда из (3.4) следует:
![]()
![]() (3.14)
(3.14)
То есть химический потенциал есть удельный потенциал Гиббса, и имеет место равенство
![]() (3.15)
(3.15)
Термодинамические потенциалы (3.1) связаны между собой прямыми соотношениями, позволяющими совершать переход от одних потенциалов к другим. Например, выразим все термодинамические потенциалы через внутреннюю энергию.
![]()
![]() (3.16)
(3.16)
![]()
При этом мы получили все термодинамические потенциалы как функции (![]() ). Для того, чтобы выразить их в других переменных, используют процедуру пере….
). Для того, чтобы выразить их в других переменных, используют процедуру пере….
Пусть задано давление ![]() в переменных (
в переменных (![]() ):
):
![]() (3.17)
(3.17)
Запишем последнее выражение в виде уравнения состояния, т.е. найдем вид
![]()
Легко видеть, что если состояние задано в переменных (![]() ), то термодинамическим потенциалом является внутренняя энергия
), то термодинамическим потенциалом является внутренняя энергия ![]() В силу (3.2) найдем
В силу (3.2) найдем
![]() (3.18)
(3.18)
Рассматривая (3.18) как уравнение относительно S, находим его решение:
![]() (3.19)
(3.19)
Подставляя (3.19) в (3.17) получаем
![]() (3.20)
(3.20)
То есть от переменных (![]() ) мы перешли к переменным (
) мы перешли к переменным (![]() ).
).
2.
Вторая группа термодинамических потенциалов возникает в том случае, если в качестве термодинамических переменных, помимо рассмотренных выше, включен химический потенциал ![]() . Потенциалы второй группы также имеют размерность энергии и могут быть связаны с потенциалами первой группы путем соотношений:
. Потенциалы второй группы также имеют размерность энергии и могут быть связаны с потенциалами первой группы путем соотношений:
![]()
![]()
![]()
![]()
![]() (3.21)
(3.21)
Соответственно дифференциалы потенциалов (3.21) имеют вид:
![]() (3.22а)
(3.22а)
![]() (3.22б)
(3.22б)
![]() (3.22в)
(3.22в)
![]() (3.22г)
(3.22г)
Также как и для термодинамических потенциалов первой группы, для потенциалов (3.21) можно построить термодинамические тождества, найти выражения параметров термодинамической системы и т.д.
Рассмотрим характерные соотношения для “потенциала омега” ![]() , выражающий квазисвободную энергию, и использующийся на практике наиболее часто среди остальных потенциалов группы (3.22).
, выражающий квазисвободную энергию, и использующийся на практике наиболее часто среди остальных потенциалов группы (3.22).
Потенциал ![]() задается в переменных (
задается в переменных (![]() ), описывающих термодинамическую систему с воображаемыми стенками. Параметры системы в этом случае определяются из соотношений:
), описывающих термодинамическую систему с воображаемыми стенками. Параметры системы в этом случае определяются из соотношений:
![]()
![]()
![]()
![]() (3.23)
(3.23)
Термодинамические тождества, следующие из потенциальности ![]() , имеют вид:
, имеют вид:
![]()
![]()
![]()
(3.24)
![]()
![]()
![]()
Достаточно интересными являются аддитивные свойства термодинамических потенциалов второй группы. Поскольку в этом случае число частиц не входит в число параметров системы, то в качестве аддитивного параметра используют объем. Тогда для потенциала ![]() получаем:
получаем:
![]() (3.25)
(3.25)
Здесь ![]() - удельный потенциал
- удельный потенциал ![]() на 1
на 1![]() . Учитывая (3.23), получаем:
. Учитывая (3.23), получаем:
![]() , соответственно,
, соответственно, ![]() (3.26)
(3.26)
Справедливость (3.26) можно доказать и на основе (3.15):
![]()