Реферат: Термодинамические потенциалы
Перейдем к использованию химического равновесия в нашем случае.
В общем случае уравнение химической реакции записывается в виде:
![]() (3.54)
(3.54)
Здесь ![]() - символы химических веществ,
- символы химических веществ, ![]() - так называемые, стехиометрические числа. Так, для реакции
- так называемые, стехиометрические числа. Так, для реакции
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Поскольку в качестве параметров системы выбраны давление и температура, которые положены постоянными. Удобно в качестве состояния термодинамического потенциала рассмотреть потенциал Гиббса G . Тогда условие равновесия системы будет заключаться в требовании постоянства потенциала G :
![]() (3.55)
(3.55)
Поскольку мы рассматриваем трехкомпонентную систему, положим ![]() . Кроме того, учитывая (3.54), можно записать уравнение баланса для числа частиц (
. Кроме того, учитывая (3.54), можно записать уравнение баланса для числа частиц (![]() ):
):
![]()
![]() (3.56)
(3.56)
Вводя химические потенциалы для каждой из компонент: ![]() и учитывая сделанные допущения, находим:
и учитывая сделанные допущения, находим:
![]()
![]() (3.57)
(3.57)
Уравнение (3.57) было впервые получено Гиббсом в 1876г. и является искомым уравнением химического равновесия. Легко заметить, сравнивая (3.57) и (3.54), что уравнение химического равновесия получается из уравнения химической реакции путем простой замены символов реагирующих веществ на их химические потенциалы. Этот прием может быть использован и при записи уравнения химического равновесия для произвольной реакции.
В общем случае решение уравнения (3.57) даже для трех компонент является достаточно загруженным . Это связанно, во-первых, с тем, что даже для однокомпонентной системы получить явные выражения для химического потенциала весьма затруднительно. Во-вторых, относительные концентрации ![]() и
и ![]() не являются малыми величинами. То есть невозможно выполнить по ним разложение в ряд. Это еще сильнее усложняет задачу решения уравнения химического равновесия.
не являются малыми величинами. То есть невозможно выполнить по ним разложение в ряд. Это еще сильнее усложняет задачу решения уравнения химического равновесия.
Физически отмеченные трудности объясняются необходимостью учета перестройки электронных оболочек атомов, вступающих в реакцию. Это приводит к определенным сложностям микроскопического описания , что сказывается и при макроскопическом подходе.
Поскольку мы условились ограничится исследованием разреженности газа, то можно воспользоваться моделью идеального газа. Будем считать, что все реагирующие компоненты являются идеальными газами, заполняющими общий объем и создающие давление p . В этом случае любым взаимодействием (кроме химических реакций) между компонентами смеси газов можно пренебречь. Это позволяет допустить, что химический потенциал i -го компонента зависит только от параметров этого же компонента.
![]() (3.58)
(3.58)
Здесь ![]() - парциальное давление i -го компонента, причем:
- парциальное давление i -го компонента, причем:
![]()
С учетом (3.58) условие равновесия трехкомпонентной системы (3.57) примет вид:
![]() (3.59)
(3.59)
Для дальнейшего анализа воспользуемся уравнением состояния идеального газа, которое запишем в виде:
![]() (3.60)
(3.60)
Здесь через ![]() , как и ранее, обозначается термодинамическая температура
, как и ранее, обозначается термодинамическая температура ![]() . Тогда известная из школы запись
. Тогда известная из школы запись ![]() принимает вид:
принимает вид: ![]() , что и записано в (3.60).
, что и записано в (3.60).
Тогда для каждого компонента смеси получим:
![]() (3.61)
(3.61)
Определим вид выражения химического потенциала идеального газа. Как следует из (2.22), химический потенциал имеет вид:
![]() (3.62)
(3.62)
Учитывая уравнение (3.60), которое можно записать в виде ![]() , задача определения химического потенциала сводится к определению удельной энтропии и удельной внутренней энергии.
, задача определения химического потенциала сводится к определению удельной энтропии и удельной внутренней энергии.
Система уравнений для удельной энтропии следует из термодинамических тождеств (3.8) и выражения теплоемкости (3.12):
![]()
![]()
Учитывая уравнение состояния (3.60) и переходя к удельным характеристикам, имеем:
![]()
![]()
![]() (3.63)
(3.63)
Решение (3.63) имеет вид:
![]()
Система уравнений для удельной внутренней энергии идеального газа следует из (2.23):
![]()
![]()
Решение этой системы запишется в виде:
![]()
Подставляя (3.64) - (3.65) в (3.66) и учитывая уравнение состояния идеального газа, получаем:
![]() (3.66)
(3.66)
Для смеси идеальных газов выражение (3.66) принимает вид:
![]()
Подставляя (3.67) в (3.59), получаем:
![]()
Выполняя преобразования, запишем:
![]()
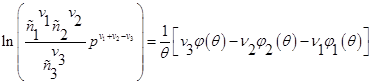
Выполняя потенцирование в последнем выражении, имеем:
![]()
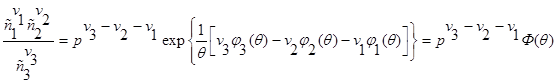 (3.68)
(3.68)