Реферат: Установление и использование межпредметных связей при изучении элементов III и V группы периодической системы Д.И. Менделеева
Алюминий Al (лат. Aluminium, от лат. alumen — квасцы). Аl— элемент III группы 3-го периода периодической системы Д. И. Менделеева, п. н. 13, атомная масса 26,9815, имеет один стабильный изотоп 27 Al (100 %). Металлический Аl был получен в 1827г. Вёлером. По содержанию в земной коре (8,8 %) Аl занимает 3-е место после О и Si, с которыми Аl (в виде различных алюмосиликатов) составляет более 82% массы земной коры. В свободном виде не встречается. Основное сырье для производства Аl – бокситы. Аl – серебристо-белый металл, легкий, прочный, пластичный, ковкий, обладает высокой электро- и теплопроводимостью, высокой химической активностью. В соединениях А. проявляет степень окисления +3. А. легко соединяется о кислородом воздуха, покрываясь плотной пленкой оксида Al2 O3 , это обусловливает высокую коррозионную стойкость; концентрированная HNO3 на Аl не действует. Аl легко растворяется в щелочах, разбавленных НС1 и H2 SO4 . Гидроксид Аl (и Аl2 О3 ) амфотерен: с кислотами водных растворах он дает соли, содержащие гидратированный ион [Al(H2 O)6 ]з+ , со щелочами — алюминаты. Аl получают электролизом Аl2 О3 (из боксита), растворенного в расплавленном криолите Na3 AlF6 , Аl применяют для производства легких сплавов (дуралюмин, силумин) в самолетостроении, автомобилестроении, при строительстве зданий, для изготовления химической аппаратуры, электрических проводов, конденсаторов, как материал для ядерных реакторов и др. Аl служит восстановителем при получении ряда металлов. Применяются различные соединения Al — алюминия оксид, хлорид алюминия АlС13 или водный А1С13 . 6Н2 О как катализатор в органическом синтезе, сульфат алюминия А12 (SО4 )3 ×18H2 O и алюмокалиевые квасцы KAl(SO4 )2 × 12Н2 О — для очистки воды, при крашении тканей, для дубления кож и в производстве бумаги. В строительстве и архитектуре для защиты от коррозии и в декоративных целях применяют серебряную краску — смесь алюминиевого порошка с минеральным маслом. Алюминийорганические соединения используют при синтезе других металлоорганических соединений; соединения Аl с алкилами применяют как катализаторы при полимеризации олефинов.
Бор В – элемент III группы 2-го периода п.с. В природе встречается в виде борной кислоты и различных минералов. Бор является сильным восстановителем. Гидриды бора применяют в топливе для ракет, как катализаторы при получении полимеров, для покрытия металлов бором, в металлургии, в ядерной промышленности.
Галлий Ga – элемент III группы п.с. Химически активен, применяется в качестве модифицирующих присадок в сплавах, в полупроводниковой промышленности.
Иттрий Y- элемент III группы 5-го периода п.с., в природе встречается вместе с лантаноидами. Иттрий используется в атомной технике и авиации.
Скандий Sс – элемент III группы 4-го периода п.с. Скандий содержится в виде примесей во многих минералах, химически активен. Применяют скандий в основном в виде сплавов с различными металлами, в ядерной технике, металлургии, медицине и пр.
Лантан La – элемент III группы 6-го периода п.с. В природе La встречается в виде сложного по составу минерала монацита.
Лантаноиды – 4f-семейство из 14 элементов VI периода п.с. В природе лантаноиды сопутствуют друг другу. Все лантаноиды – металлы серебристо-белого цвета, пластичны и легко поддаются ковке, литью. Лантаноиды химически активны, разлагают воду, реагируют с кислотами. Лантаноиды находят очень широкое применение – в изготовлении лаков и красок, в производстве кожи, в текстильной промышленности, в радиоэлектронике и пр.
Таллий Tl – элемент III группы 6-гопериода п.с., относится к рассеянным элементам, легко разлагает кислоты. Производство таллия связано с комплексной переработкой сульфидных руд цветных металлов. Токсичен.
Актиний Ас – радиоактивный элемент III группы п. с. Период полураспада Ас составляет 22 года, испускает b-частицы (98 %) и a-частицы. Получают облучением радия нейтронами. Ас – металл серебристо-белого цвета, в соединениях проявляет с.ок. +3, по химическим свойствам близок к лантану. Ас – опасный радиоактивный яд.
Актиноиды – 5f-семейство элементов 7 периода п. с., все радиоактивны [2].
К III группе периодической системы относятся следующие элементы: бор В, алюминий Al, скандий Sc, галлий Ga, иттрий Y, лантан La (лантаноиды), таллий Tl, актиний Ac (актиноиды).
Данная тема изучается в школьной программе в 9 классе по учебнику Ф. Г. Фельдмана и Г. Е. Рудзитиса [3]. На изучение элементов III группы отводится лишь 2 часа.
В школьном учебнике Ф. Г. Фельдмана и Г. Е. Рудзитиса этой теме посвящен лишь один параграф, к тому же тема освещена не лучшим образом. Авторы учебника подробно рассматривают лишь один из элементов III группы – алюминий. В этом параграфе рассматриваются следующие подпункты.
2.1.1 Положение алюминия в периодической системе и строение его атома
Алюминий находится в главной подгруппе III группы. Схема расположения по энергетическим уровням следующая:
+3 Al 2e- , 8e- ,3e-
Так как у атомов алюминия на внешнем уровне 3 электрона, то алюминий в соединениях проявляет степень окисления 4-3.
К такому же выводу приходим, руководствуясь представлениями о характере движения электронов в атомах и расположении их не только по энергетическим уровням, но и по подуровням. В атоме алюминия легко происходит распаривание 3s2 -электронов и один электрон переходит 3p-орбиталь:
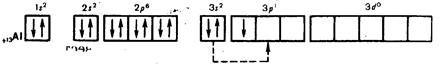
В результате получаются три неспаренных электрона. Ответьте на вопрос 1 (с. 138 [4]).
2.1.2 Нахождение алюминия в природе, его получение и свойства
Алюминий — третий по распространенности элемент в земной коре. Он встречается только в соединениях. Важнейшие из них указаны на схеме 19.
Схема 19
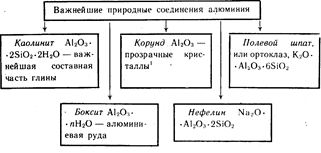
Окрашенные кристаллы Al2 O3 красного цвета — рубины, синего цвета – сапфиры.
Получение
Немецкий химик Ф. Вёлер в 1827 г. получил алюминий при нагревании хлорида-алюминия со щелочными металлами калием или натрием без доступа воздуха.
AlCl3 +3K![]() 3KCl + Al
3KCl + Al
Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан электрохимический метод получения алюминия из бокситов.
Физические свойства
Алюминий — серебристо-белый металл, легкий (r = 2,7 г/cм3 ), плавится при 660 °С. Он очень пластичен, легко вытягивается в проволоку и прокаливается в листы и фольгу. По электрической проводимости алюминий уступает лишь серебру и меди (она составляет 2/3 от электрической проводимости меди).