Реферат: Установление и использование межпредметных связей при изучении элементов III и V группы периодической системы Д.И. Менделеева
а) NaA1O2 -Н2 О, или NaH2 A1O3 ; б) NaA1O2 -2H2 O, или NaAl(OH)4 .
Гидроксид алюминия
Гидроксид алюминия А1(ОН)3 получают при взаимодействии раствора щелочи с растворами солей алюминия (раствор щелочи нельзя брать в избытке):
АlCl3 + NaOͮAl(OH)3 ¯ + 3NaCl
A13+ + 3Cl- + 3Na+ + 3OH- ® Al(OH)3 ¯ + 3Na+ + 3С1-
Аl3+ + 3ОН- ® А1(ОН)3 ¯
Если белую желеобразную массу гидроксида алюминия выделить из раствора и высушить, то получается белое кристаллическое вещество, практически не растворяющееся в воде.
Гидроксид алюминия (как и его оксид) обладает амфотерными свойствами. Подобно всем основаниям гидроксид алюминия реагирует с кислотами. При сплавлении гидроксида алюминия со щелочами образуются метаалюминаты, а в водных растворах — гидраты метаалюминатов:
А1(OH)3 + NaOH![]() NaА1O2 + 2Н2 O
NaА1O2 + 2Н2 O
А1(OH)3 + NaOH®NaH2 А1O3 + Н2 O
Соли алюминия получают в основном при взаимодействии металлического алюминия с кислотами. По физическим свойствам это твердые кристаллические вещества, хорошо растворимые в воде. Химические свойства солей алюминия аналогичны свойствам других солей ([3], с. 98—99). Так как соли алюминия образованы слабым основанием и сильной кислотой, то они в водных растворах подвергаются гидролизу (с. 18).
Ответьте на вопросы 7—10 (с. 138). Решите задачу 3 (с. 138 [4]).
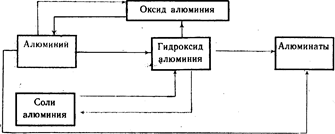
Генетическая связь между алюминием и его важнейшими соединениями (схема 20).
Выполните упражнение 11.
Далее в учебнике по этой теме приводятся задачи на закрепление материала. Также в учебнике приводится лабораторный эксперимент (с. 139) [4].
Таким образом, из вышеизложенного материала можно сделать вывод, что в школьной программе на изучение данной темы отводится очень мало часов, и, кроме этого, практически нет сведений об экологических аспектах этой темы.
Азот образует ряд оксидов, формально отвечающих всем возможным степеням окисления от +1 до +5: N2 O, NО, N2 O3 , NO2 , N2 O5 , однако всего два из них – оксид азота(II) и оксид азота(IV) – не только устойчивы при обычных условиях, но и активно задействованы в природном и промышленном круговоротах азота.
2.2.1 Некоторые соединения азота и их свойства
1.2.1.1. Оксиды азота
N2 +1 O – оксид азота(I), закись азота, «веселящий» газ, несолеобразующий оксид. Получают N2 O разложением аммиачной селитры:
![]()
N2 O имеет слабый приятный запах и сладковатый вкус. С кислородом, водой, растворами кислот и щелочей не реагирует. Разлагается на элементы при температуре выше 500 °С, иными словами, достаточно устойчив.
Строение: у кислорода 2 неспаренных электрона, у азота 3 – образуется двойная связь и один неспаренный электрон в остатке. Можно предположить, что молекулы NO будут спариваться и образовывать димерную молекулу ONNO. Строение молекулы: линейная молекула О=N=N, в которой центральный атом N четырехвалентен. Он образует две двойные связи: одну – с кислородом по типичной схеме создания ковалентной связи (два электрона азота, два электрона кислорода), другую – с атомом азота (который два из своих трех неспаренных электронов спаривает и образует за счет этого пустую орбиталь), одна из связей ковалентная, вторая донорно-акцепторная (рис. 1).
Установка для получения оксида азота(I) состоит из штативов, пробирки, пробки с газоотводной трубкой, кристаллизатора, цилиндра и спиртовки (рис. 2). В пробирку помещают NH4 NO3 , закрывают пробкой с газоотводной трубкой и нагревают. Газ собирают в цилиндр, наполненный водой.
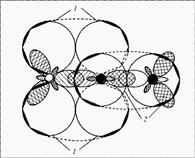
Рис. 1. Молекула оксида азота(I) – N2 O
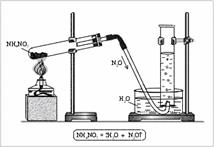 |
| Рис. 2. Получение оксида азота(I) в лаборатории |
Оксид N2 O разлагается при нагревании:
![]()
Оксид N2 O реагирует с водородом:
![]()