Реферат: Установление и использование межпредметных связей при изучении элементов III и V группы периодической системы Д.И. Менделеева
В электрохимическом ряду напряжения алюминий помещается за самыми активными металлами. Однако из повседневного опыта известно, что на алюминиевые изделия (посуду и т. д.) не действует ни кислород, ни вода даже при температуре ее кипения. На алюминий не действует также концентрированная холодная азотная кислота. Это объясняется наличием на поверхности алюминия тонкой оксидной пленки, которая предохраняет его от дальнейшего окисления. Если поверхность алюминия потереть солью ртути, то происходит реакция:
2А1 + 3HgCl2 ® 2А1С13 + 3Hg
Выделившаяся ртуть растворяет алюминий, и образуется его сплав с ртутью — амальгама алюминия. На амальгамированной поверхности пленка не удерживается, поэтому алюминий реагирует с водой при обычных условиях (рис. 46):
2А1 + 6НОН ® 2А1(ОН)3 ¯ + 3Н2
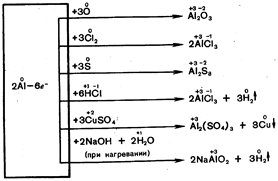
При повышенной температуре алюминий реагирует со многими неметаллами и сложными веществами без амальгамирования:
Применение
Алюминий применяют для производства различных сплавов. Наибольшее распространение имеют дюралюмины, содержащие медь и магний, и силумины — сплавы алюминия с кремнием. Основные преимущества этих сплавов—легкость и высокая прочность. Упомянутые сплавы широко используют в авиа-, авто-, судо- и приборостроении, в ракетной технике и в строительстве. В виде чистого металла алюминий идет на изготовление электрических проводов и различной химической аппаратуры.
Алюминий используют также для алитирования, т. е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии.
На практике часто используют термит (смесь оксида Fе3 O4 с порошком алюминия). Если эту смесь поджечь (с помощью магниевой ленты), то происходит бурная реакция с выделением большого количества теплоты:
8Al + 3Fe3 O4 ® 4Al2 O3 + 9Fe
Этот процесс используют при так называемой термитной сварке, а также для получения некоторых металлов в свободном виде.
Ответьте на вопросы 2—6 (с. 138). Решите задачи 1 – 2 (с. 138). [4]
2.1.3 Важнейшие соединения алюминия
Оксид алюминия
Аl2 О3 можно получить следующими способами:
1. Непосредственным сжиганием порошка металлического алюминия (вдуванием порошка алюминия в пламя горелки):
4Al+ 3O2 ® 2А12 O3
2. Путем превращения по приведенной ниже схеме:
![]()
Оксид алюминия — твердое, тугоплавкое (темп. пл. 2050 °С) вещество белого цвета.
По химическим свойствам это амфотерный оксид (I, § 37). Реагирует с кислотами, проявляет свойства основных оксидов:
А12 O3 + 6НС1 ![]() 2А1С13 + 3Н2 O
2А1С13 + 3Н2 O
Al2 O3 + 6H+ +6С1- ![]() 2Al3+ + 6С1- + 3Н2 O
2Al3+ + 6С1- + 3Н2 O
А12 O3 + 6Н+ ![]() 2A13+ + 3Н2 O
2A13+ + 3Н2 O
Оксид алюминия реагирует со щелочами и проявляет свойства кислотных оксидов. Причем при сплавлении образуются соли метаалюминиевой кислоты НА1O2 , т. е. мета-алюминаты:
Al2 O3 + 2NaOH ![]() 2NaA102 + H2 0
2NaA102 + H2 0
В присутствии воды реакция протекает иначе:
А12 О3 + 2NаОН + Н2 O® 2[NaA1O2 . H2 O]