Статья: Химическая кинетика и равновесие в гомогенных системах
с неразветвленными цепями;
с разветвленными цепями.
К первому типу относится фотохимический синтез HCl. Цепь возникает в результате образования атомов – радикалов. ЕCl-Cl =58,0 ккал/моль; ЕН-Н = 104,2 ккал/моль.
Cl2 + hn = 2Cl× зарождение цепи
 развитие цепи
развитие цепи
………………………….
 обрыв цепи
обрыв цепи
За счет внешнего источника энергии (свет, электрический разряд, нагревание, воздействие ά-, β- или γ- излучения) образуются свободные радикалы или атомы, обладающие свободными валентностями. Они взаимодействуют с молекулами. В каждом звене цепи вновь образуется новая активная частица. Путем повторения одних и тех же элементарных процессов происходит протекание цепной реакции. Ее продолжительность может быть очень большой. В приведенной выше реакции на каждый поглощенный квант образуется до 100 тыс. молекул НСl. Столкновение двух одинаковых радикалов при условии, что выделяющаяся при этом энергия может быть отдана третьему телу, приводит к обрыву цепи. Причиной обрыва может служить не только рекомбинация свободных радикалов, но и их захват стенкой реакционного сосуда, взаимодействие радикала с примесями, а также образование малоактивного радикала (обрыв в объеме). Поэтому скорость цепной реакции очень чувствительна к наличию посторонних частиц и форме сосуда.
В разветвленных цепных реакциях единичная реакция одного свободного радикала приводит к возникновению более чем одного нового свободного радикала. ![]()

Образующиеся в реакции I радикалы обеспечивают развитие неразветвленной цепи, а атом кислорода, обладающий двумя свободными валентностями (реакция II), образует два радикала, начинающих разветвление. Возникает огромное количество свободных радикалов. «Размножение» радикалов приводит к лавинообразному течению процесса, которое может вызвать взрыв:
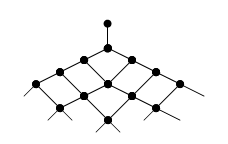 Однако и в этих процессах происходят обрывы цепей. Причем бурное увеличение скорости процесса наблюдается лишь в том случае, когда темп разветвления опережает темп обрыва.
Однако и в этих процессах происходят обрывы цепей. Причем бурное увеличение скорости процесса наблюдается лишь в том случае, когда темп разветвления опережает темп обрыва.
Для таких реакций изменение концентрации активных центров во времени может быть выражено следующим соотношением:
 ,
,
где С – количество активных центров в зоне реакции;
![]() - скорость зарождения активных центров;
- скорость зарождения активных центров;
f – константа скорости разветвления цепей;
g – константа скорости обрыва цепей.
Химические реакции делятся на обратимые и необратимые
Химически необратимые реакции при данных условиях идут практически до конца, до полного расхода одного из реагирующих веществ (NH4NO3 → 2H2O + N2O – никакая попытка получить нитрат из Н2О и N2O не приводит к положительному результату).
Химически обратимые реакции протекают одновременно при данных условиях как в прямом, так и в обратном направлении. Необратимых реакций меньше, чем обратимых. Примером обратимой реакции служит взаимодействие водорода с иодом:
![]()
![]() ;
;  .
.
Через некоторое время скорость образования HI станет равной скорости его разложения:
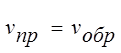 ;
; ![]() .
.
Иными словами, наступит химическое равновесие:
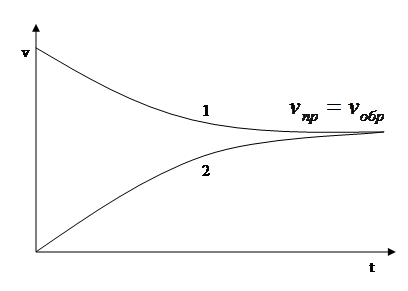
Рис. 5.7. Изменение скорости прямой (1) и обратной (2) реакций
с течением времени.