Статья: Химическая кинетика и равновесие в гомогенных системах
![]() .
.
Если увеличить давление в закрытом реакционном сосуде, например, в 2 раза, то объем изменится тоже вдвое. Соответственно, вдвое изменится и концентрация газов. Скорость прямой и обратной реакций возрастает, но в равное количество раз. Поэтому смещения химического равновесия при этом не происходит.
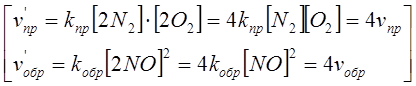 .
.
Таким образом, если объемы исходных и конечных газообразных продуктов равновесной системы равны между собой, то изменение давления не нарушает равновесия.
Б). Сумма молей исходных веществ больше суммы молей образующихся продуктов:
N2 + 3H2 Û 2NH3.
Из четырех молей исходных веществ образуется два моля продуктов - реакция протекает с уменьшением объема. [При повышении давления концентрация исходных веществ будет увеличиваться в большей степени, чем концентрация продуктов, что приводит к смещению равновесия в сторону образования аммиака.]
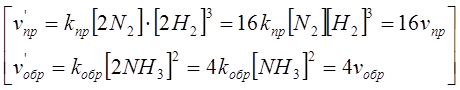 .
.
В). Сумма молей исходных веществ меньше суммы молей продуктов:
N2O4 <=> 2NO2;
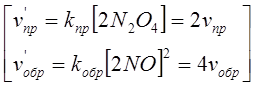 .
.
Прямая реакция ведет к увеличению числа молей вещества в системе, то есть к увеличению давления.
При протекании обратной реакции, наоборот давление в системе падает. Если при установившемся равновесии повысить давление, то система окажет противодействие, стремясь к начальному состоянию. Равновесие будет смещаться в сторону обратной реакции, сопровождающейся понижением давления, то есть в сторону образования N2O4. Если давление снизить, то равновесие сместится в сторону прямой реакции, сопровождающейся повышением давления, то есть в сторону образования NO2.
Выводы:
при изменении давления равновесие смещается только в тех обратимых реакциях, которые сопровождаются изменением объемов газообразных веществ;
повышение давления сдвигает равновесие в сторону меньших объемов, понижение – в сторону больших объемов.
Влияние температуры на состояние равновесия
2Н2 + О2 <=> 2Н2О(г) + 484,9 кДж.
Процесс образования воды является экзотермическим, разложение – эндотермическим.
В соответствии с принципом Ле Шателье при подведении теплоты к этой равновесной системе равновесие должно смещаться в сторону эндотермической реакции, то есть должно приводить к разложению воды. В результате этого произойдет уменьшение равновесной концентрации водяного пара и увеличение равновесных концентраций водорода и кислорода.
Охлаждение этой системы приведет к усилению экзотермического процесса.
Рассмотрим систему:
N2 + 3H2 <=> 2NH3 + 92кДж.
Понижение температуры смещает равновесие вправо, то есть увеличивает выход NH3. Однако в промышленности этот процесс ведется при довольно высоких температурах. Это вызвано тем, что при низких температурах скорость установления равновесия мала, хотя выход целевого продукта выше.
Таким образом, при нагревании равновесной системы равновесие смещается в сторону эндотермической реакции, при охлаждении – в сторону экзотермической реакции.
Влияние катализаторов на состояние равновесия
Введение катализаторов в равновесную систему не вызывает смещения равновесия, поскольку катализатор, ускоряя прямую реакцию, в такой же мере ускоряет и обратную реакцию. Но введение катализаторов позволяет добиваться наступления равновесия в более короткие сроки.
Список литературы
Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 166-191.
Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 102-115.