Статья: Основные классы неорганических соединений и типы химических реакций
3
1
H H
N—N
H H
-2
+1
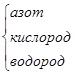
3
2
1
H
N O H
H
-1
-2
+1
Определение степени окисления элемента в какой либо молекуле сводится к простой арифметической операции, так как сумма степеней окисления атомов всех элементов, входящих в состав молекулы, равна нулю. Например, необходимо определить степень окисления фосфора в фосфорной кислоте Н3РО4. Поскольку у кислорода СО – -2 , а у водорода - +1, то для нулевой суммы у фосфора степень окисления должна быть равна 5:
[3(+1)+1(+5)+4(-2)=0].
Характерные особенности окислительно-восстановительных реакций
Существует обширный класс химических реакций, в ходе которых степень окисления у атомов или ионов изменяется. Например, это реакция
Zn+2HCl=ZnCl2+H2↑.
В ней участвуют атомы цинка, водорода и хлора; измененная в ходе реакции степень окисления (СО) цинка повышается от 0 до +2, а ионов водорода – понижается от +1 до 0.
Реакции, сопровождающиеся изменением степени окисления элементов, называются окислительно-восстановительными.
Окислением называется процесс отдачи электронов, сопровождающийся повышением СО.
Вещество, в состав которого входит элемент, способный отдавать электроны, называется восстановителем. В процессе отдачи электронов восстановитель окисляется.
Присоединение электронов, сопровождающееся понижением степени окисления, называется восстановлением.
Вещество, в состав которого входит элемент, способный присоединить электроны, называется окислителем. В процессе присоединения электронов окислитель восстанавливается.
Известно, что атомы металлов имеют на внешнем энергетическом уровне мало электронов (1-3) и способны отдавать их при химических реакциях, то есть окисляются, а неметаллы (на внешнем энергетическом уровне от 4 до 7 электронов) склонны присоединять электроны и восстанавливаться, следовательно, атомы металлов – восстановители (отдавая электроны, сами окисляются), а атомы неметаллов – окислители (присоединяя электроны, сами восстанавливаются).
Приведем примеры окислительно–восстановительных реакций.
1. Горение магния на воздухе (или в кислороде):