Учебное пособие: Амины
По систематической номенклатуре амины называют путем добавления приставки амин к названию углеводорода. По рациоальной номенклатуре их рассматривают как алкил или ариламины.
![]()
![]()
![]()
![]()
Метанамин Этанамин N-Метилэтанамин N-Этилэтанамин
(метиламин) (этиламин) (метилэтиламин) (диэтиламин)
![]()
![]()
![]()
N,N-Диэтилэтанамин 2-Аминоэтанол 3-Аминопропановая
триэтиламин) (этаноламин) кислота
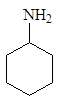
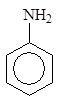

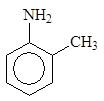
Циклогексанамин Бензоламин N-Метилбензоламин 2-Метилбензоламин
(циклогексиламин) (анилин) (N-метиланилин) (о -толуидин)
Гетероциклические амиы называют по соответствующему углеводороду вставляя приставку аза-, диаза- или триаза- для обозачения количества атомов азота.
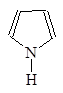
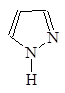
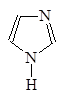
1-Азациклопета- 1,2-Диазациклопета- 1,3-Диазациклопета-
2,4-диен 2,4-диен 2,4-диен
1. Основность аминов
Аммиак и амины благодаря наличию на их атомах азота неподеленной пары электронов обладают нуклеофильными свойствами, т.е. предоставляют эту пару обедненному электронами атому углерода. Они способны предоставлять ее и протону, т.е. обладать основностью.
Основные свойства аминов (Kb = 10-4 ) обусловлены способностью свободных (неподеленных) электронов атомов азота присоединять протон. Подобно аммиаку амины при действии минеральных кислот превращаются в соли:
![]() (22)
(22)
Метиламмонийхлорид
Основность аминов тем выше, чем больше электронная плотность на атоме азота (чем выше электронодонорный характер атома азота).
Все простейшие алифатические амины, взаимодействуя с водой, генерируют гидроксид-анион и, следовательно, окрашивают лакмус в синий цвет:
![]()
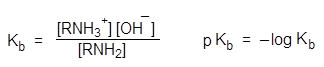
Сравнивать основность аминов можно и по значениям pKa сопряженных им кислот – аммониевых ионов.
![]()

pKa + pKb = 14
Чем выше основность амина, тем сильнее он удерживает протон в аммониевом катионе RNH3 + и наоборот.
Алифатические амины - более сильные основания, чем аммиак, поскольку алкильные группы обладают +I-эффектом.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--