Учебное пособие: Практикум по энзимологии
Степень
очистки
| Фракция | 12 | 14 | 16 | 18 | 20 | 22 | 24 |
| Активность | |||||||
|
Степень очистки |
Работа 11. Изучение субклеточного распределения ДНКазы (фермента-маркера ядерной фракции) в животных тканях
Оборудование и реактивы: центрифуга с охлаждением; ФЭК; гомогенизатор; печень животного; пипетки; ДНК; 0,1 М NaOH; 0,01% раствор крезолового красного; 0,32 М р-р сахарозы, содержащий 0,01 М трис-буфер рН 7,4 (среда А); 0,32 М р-р сахарозы, содержащий 0,01 μМ MgCl2 ∙6H2 OрН 5,0 (среда Б); набор растворов для определения белка по Лоури.
Навеску ткани 2 г переносят в стакан гомогенизатора и добавляют 20 мл среды Б, гомогенизируют. Отбирают 2 мл на определение активности фермента и содержания белка в гомогенате. Центрифугирование и отбор фракций для анализа производят по следующей схеме.
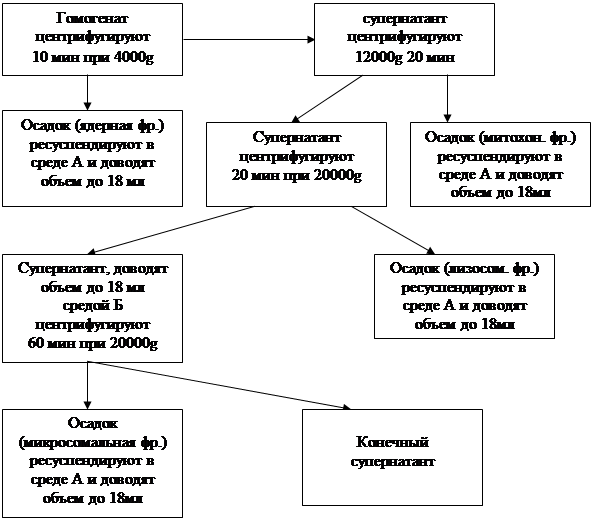
Ресуспендирование проводят гомогенизированием полученных осадков в 4-6 мл среды гомогенизации (б), затем полученную суспензию переносят количественно в мерный цилиндр на 20 мл и объем суспензии доводят до 18 мл; таким образом, концентрация субклеточных структур достигает исходной (как в гомогенате) концентрации.
Активность ДНКазы определяют в исходном гомогенате, ядерной, митохондриальной, лизосомальной, микросомальной и растворимой клеточной фракции по следующей схеме.
| 1 мл раствора ДНК (1 мг/мл) |
| 1 мл 0,01% раствора крезолового красного |
| 1 мл буфера А |
| Преинкубация 8 минут при 37 °С |
| 1 мл нагретого раствора фракции |
Смесь быстро переливают в фотометрическую кювету (L=1 см) и измеряют оптическую плотность на ФЭК при 590 нм против буфера А. После измерения смесь немедленно переливают в исходную пробирку и инкубируют 20 мин при 37°С. Измеряют оптическую плотность системы после инкубации. Количество белка определяют по Лоури.
Содержание отчета
1. Расчет полученных данных представляют в виде таблицы.
| Фракции | Г | Я | ТМ | ЛМ | Р | С | ||||||
| Анализируемые пробы | Оп. Кн. | Оп. Кн. | Оп. Кн. | Оп. Кн. | Оп. Кн. | Оп. Кн. | ||||||
|
Оптическая плотность, в каждой параллели и среднее | ||||||||||||
| Аоп – Акн | ||||||||||||
| Активность на 1 мг ткани | ||||||||||||
| Активность фракции в % от гомогената | 100 % | |||||||||||
| Количество белка на 1 мг ткани | ||||||||||||
| Белок в % от белка гомогената | 100 % | |||||||||||
| Относительная удельная активность фракций | ||||||||||||
Работа 12. Изучение субклеточного распределения кислых протеаз (ферментов-маркеров лизосом) в животных тканях
Оборудование и реактивы: центрифуга; печень животного; пипетки; 0,01 М фосфатный буфер, содержащий 0,32 М сахарозы, рН 7,55; 100 мМ натрий-ацетатный буфер рН 3,3; 8% раствор гемоглобина; 5% раствор трихлоруксусной кислоты (ТХУ); тирозин кристаллический; 0,32 М р-р сахарозы, содержащий 0,01 М трис-буфер рН 7,4 (среда А); 0,32 М р-р сахарозы, содержащий 0,01 μМ MgCl2 ∙6H2 OрН 5,0 (среда Б).
Навеску ткани 2 г переносят в стакан гомогенизатора и добавляют 20 мл среды Б, гомогенизируют. Отбирают 2 мл на определение активности фермента и содержания белка в гомогенате. Центрифугирование и отбор фракций для анализа производят по схеме, приведенной в работе № 11.
Активность кислых протеаз определяют в исходном гомогенате, ядерной, митохондриальной, лизосомальной, микросомальной и растворимой клеточной фракции по следующей схеме.
| опыт | контроль |
| 200 мкл фракции | 200 мкл фракции |
| 600 мкл NaAc буфера, рН 3,3 | 800 мкл NaAc буфера, рН 3,3 |
| Преинкубация 8 минут при 37°С | |
| 200 мкл 8% раствора гемоглобина | – |
| Инкубация 40 минут при 37°С | |
| 1 мл 5 % ТХУ | 1 мл 5 % ТХУ |
Пробы центрифугируют 30 мин при 4000 об/мин. Отбирают 1 мл надосадочной жидкости и определяют количество образовавшегося тирозина спектрофотометрически при 280 нм. Количество белка в супернатанте определяют спектрофотометрически при 280 нм. Активность фермента определяют по калибровочному графику.
Построение калибровочного графика
Готовят рабочий раствор тирозина с концентрацией 100 мкг/мл. Затем производят его разведение в