Учебное пособие: Предельные углеводороды
Алканами называются предельные (насыщенные) углеводороды, содержащие только простые связи С-С. Общая формула алканов - Сn Н2 n +2 . Названия простейших алканов сложились исторически, для остальных - производятся от греческих числительных добавлением суффикса - ан .
| СН4 | метан | С5 Н10 | пентан | С9 Н20 | нонан |
| С2 Н6 | этан | С6 Н12 | гексан | С10 Н22 | декан |
| С3 Н8 | пропан | С7 Н16 | гептан | С11 Н24 | ундекан |
| С4 Н10 | бутан | С8 Н18 | октан | С12 Н26 | додекан |
Алканы с числом атомов углерода больше четырех имеют скелетные изомеры. Разветвленные предельные углеводороды рассматривают как алканы, в которых некоторые атомы водорода заменены на радикалы. Структуры и названия простейших радикалов необходимо запомнить.
Физические свойства
Первые четыре алкана - газы, далее до алкана С16 Н34 - жидкости, остальные - твердые вещества. Все они нерастворимы в воде.
Получение
I. Основной промышленный метод - переработка нефти и газа:
 |
перегонка - ?????????? ??????? ?????????? ????? ?? ??????? ? ?????????? ????????????? ??????? ?????????????: ?????? (40-150 ??), ??????? (120-240 ??), ??????? (150-300 ??) ? ????????? ?????(>300 ??);
крекинг:
получение алканов из угля и водорода при высокой температуре:
С+2Н2 ¾® СН4 .
нагреванием оксида углерода(П) с водородом в присутствии катализатора:
nСО + (2n+1) H2 ¾®Cn H2 n +2 +nН2 0
II. Лабораторные методы.
Восстановление непредельных соединений :
Сплавление натриевых солей карбоновых кислот со щелочью :
 |
Взаимодействие галогенопроизводных с металлическим натрием (реакция Вюрца):
СНз¾Вг + 2 Na + Br-CH3 ¾® СНз¾СНз + 2 NaBr
Этот метод удобен для получения симметричных алканов, в противном случае образуется смесь продуктов.
Химические свойства алканов
Благодаря своей предельной насыщенности и малой полярности связей С-Н алканы очень прочны, вступают только в реакции радикального замещения, инициируемого условиями проведения реакции.
Галогенирование - протекает на свету. Обычно не заканчивается замещением одного атома водорода, приводя к смеси моно-, ди-, три- и т.д. галогенпроизводных.
CH3 ¾CH3 + Cl2 ¾® CH3 ¾CH2 ¾Cl + HCl (SR )
Каждая такая реакция протекает в соответствии с цепным свободно-радикальным механизмом:
????????????? ????:
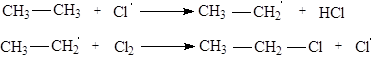 |
???? ????:
????? ????:
2)Нитрование (реакция Коновалова).
Взаимодействие алканов с разбавленной азотной кислотой (12%) при повышенных температуре и давлении.
СНз¾СНз+ HO¾NO2 ¾®CH3 ¾CH2 ¾NO2 +Н2 O
3) Окисление.
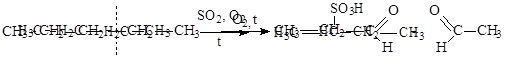 |
?????? ?????????? (??????? ????, ??????????? ?????) ?? ?????? ?? ?????????. ????? ?????? ??????? ?? ??????????? ???? ? ???? ? ?????????? ???????? ?????????? ?????.
Сульфоокисление.
Крекинг – это и способ получения, и химическое свойство алканов и алкенов. Процесс проходит при высокой температуре, давлении и обычно в присутствии катализаторов.
Циклоалканы: общая формула класса Cn H2 n , т.е. циклоалканы изомерны алкенам. Названия образуются прибавлением приставки цикло- к названию соответвующего алкана.
 |
Циклопропан ????????? ??????? ????????????? ????????, ??????????? ??? ????????????? ?????????. Циклопентатвые ? циклогексановые ?????? ?????????? ? ????????? ????????? ?????????.
Получение
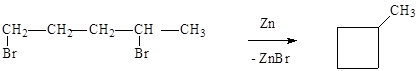 |
Действие металлического цинка на дигалогенпроизводные.
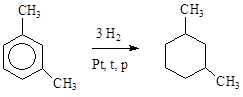 |
Гидрирование ароматических углеводородов.
Химические свойства
Химические свойства циклоалканов аналогичны реакциям алканов, но для малых циклов (циклопропан, циклобутан) характерны реакции присоединения с разрывом цикла.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--