Билеты: Гомогенное химическое равновесие
Для рассматриваемой реакции ![]()
Подставим содержание веществ (в молях) в выражение для константы равновесия:
![]()
откуда

т.к. в ходе реакции число молей в системе не меняется. Исключая из этих уравнений ![]() , получим уравнение:
, получим уравнение:
![]()
Его решение даёт два действительных корня:![]() . Это означает, что в исходной смеси СО(г) по объёму может быть 36,1 или 63,9% и, соответственно, Н2 О(г) 63,9 или 36,1%.
. Это означает, что в исходной смеси СО(г) по объёму может быть 36,1 или 63,9% и, соответственно, Н2 О(г) 63,9 или 36,1%.
№5
Реакция образования водяного пара протекает по уравнению:
![]()
Константа равновесия равна:
![]()

Диссоциация двуокиси углерода:
2CO+O2 =2CO2

Диссоциация водяного пара:

Равновесная концентрация кислорода в данных реакциях одинакова, тогда:

Выразим константу равновесия реакции диссоциации воды и двуокиси углерода через общее давление и степень диссоциации:

По условию начальные об. конц. воды и укиси углерода равны 50об.%, обозначим конц. образ. Н2 и СО2 в сост. равновесия x об.%, получим:![]()

Состав водяного газа имеет вид:
![]()
Ответ. 15,95 об.%
№6
Напишем равновесные числа молей реагентов, выраженные через степень диссоциации ![]() :
:
![]()
n0 –начальное количество (число молей) водяного пара.
Константа равновесия этой реакции будет выражаться уравнением:
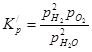
Выразим парциальные давления реагентов через общее давление Р, общее число молей ![]() и степень диссоциации
и степень диссоциации ![]() . Находим:
. Находим:
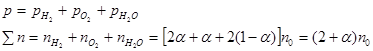
Парциальные давления реагентов вычисляются по уравнению ![]() :
:
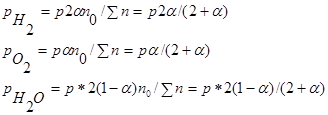
Таким образом, 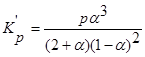
Т.к.![]() можно считать
можно считать![]() и
и ![]() , поэтому
, поэтому
![]()
Для обратной реакции, т.е для реакции горения водорода при 1500К, получим:
![]()
Ответ. ![]()
№7
Зависимость теплового эффекта от температуры опред. законом Кирхгоффа:
![]()
По справочнику [M] находим зависимость теплоёмкости веществ от температуры
| Вещество | Зависимость теплоёмкости от температуры, Дж/кмоль*град | |||
| 44,14 | 9,04 | - | -8,54 | |
| 29,10 | -0,84 | - | - | |
| 27,63 | 5,02 | - | - | |
| 30,12 | 11,30 | 2,01 | - | |
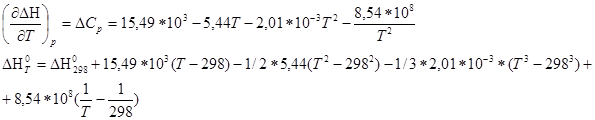
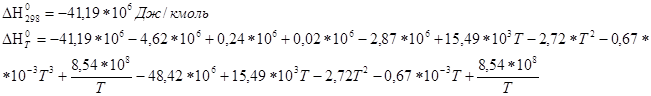
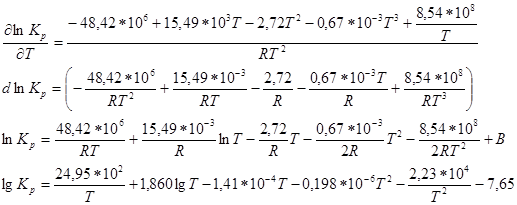
По уравнению находим Кр при 600К:
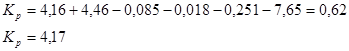
Ответ. ![]()
Тест
В вопросах 1-10 необходимо выбрать правильный ответ (он может быть только один).
1. При наступлении состояния химического равновесия протекают следующие процессы:
а) число молекул веществ, составляющих химическую систему увеличивается во времени при неизменных внешних условиях;
б) число молекул веществ, составляющих химическую систему остаётся постоянным во времени при неизменных внешних условиях;
в) число молекул веществ, составляющих химическую систему, уменьшается во времени при неизменных внешних условиях.
2. Для реакции: ![]() протекающей в изобарно-изотермических условиях, общее выражение для изменения энергии Гиббса имеет вид:
протекающей в изобарно-изотермических условиях, общее выражение для изменения энергии Гиббса имеет вид:
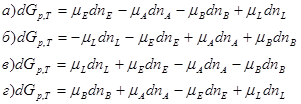
3. Для состояния химического равновесия характерно:
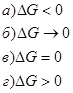
4. Уравнение изотермы химической реакции имеет вид:
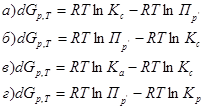
5. Для реакции: ![]()
Константа равновесия, выраженная через парциальные давления газов, записывается так:
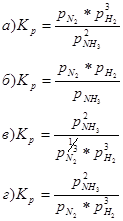
6. Какое из выражений соответствует уравнению изобары химической реакции:
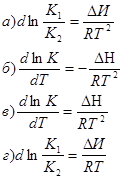
7. Стандартная константа равновесия связана с константой равновесия Кр соотношением:
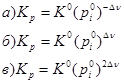
![]()