Контрольная работа: Межмолекулярные взаимодействия
где Ue \Q - энергия непосредственно электростатического взаимодействия, aUm d и CZdis - энергии индукционного и дисперсионного взаимодействий соответственно.
В качестве примера на рис. показана энергия взаимодействия между двумя молекулами воды, рассчитанная квантовомеханическим способом.
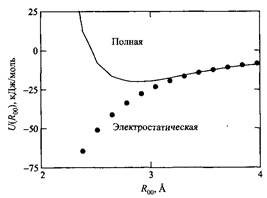
Энергия взаимодействия между двумя молекулами воды, рассчитанная неэмпирическим квантовомеханическим методом. Сплошная линия - полная энергия взаимодействия U. Точками показан вклад электростатической составляющей Lr e Ie .
Такое распределение энергии на несколько вкладов не является единственно возможным. Оно предполагает, что взаимодействующие частицы сохраняют индивидуальность и все присущие им свойства.
Но это условие не всегда выполняется: любая химическая реакция с образованием новых ковалентных связей служит типичным примером непригодности такого подхода.
Рассмотрим, например, образование воды из О2 и Н2. Ни один из реагентов, вступающих в реакцию, не имеет дипольного момента, в то время как продукт реакции обладает очень большим дипольным моментом.
Разделение и классификация вкладов различных взаимодействий является в некотором смысле персональным выбором. Водородную связь и комплексы с переносом заряда не имеет смысла рассматривать как отдельные виды взаимодействий. Водородную связь можно описать с помощью электростатического вклада UQ \Q , а перенос заряда в основном представляет собой индукционное взаимодействие, включенное в Сind . Безусловно, указанные четыре типа взаимодействий не независимы, но для большинства систем члены, характеризующие их взаимосвязь, малы и ими можно пренебречь.
Распределять суммарную энергию взаимодействия на отдельные вклады можно и для внутримолекулярных взаимодействий в больших молекулах, таких как белки или полимеры. В этом случае атомы или группы атомов, разделенные друг от друга более чем тремя или четырьмя связями, рассматривают как принадлежащие разным молекулам. Обычно из-за неявности данного приближения выделяют вклады связей, валентных углов и диэдральных углов. Некоторые виды внутримолекулярных движений относятся к почти классическим, например вращение вокруг связи, в то время как быстрые колебания связи являются строго квантовомеханическими. Эти силы невозможно точно описать. Учитывая задачи данного изложения, можно ограничиться оценочными классическими приближениями.
Электростатические взаимодействия
Для двух произвольно выбранных распределений заряда![]() и
и![]() энергия кулоновского взаимодействия описывается уравнением
энергия кулоновского взаимодействия описывается уравнением
![]()
Для двух точечных зарядов выражение приводится к виду
![]()
Обычно распределение заряда представляют мультипольным рядом, что позволяет рассматривать отдельно ион-ионные, ион-дипольные, диполь-дипольные и т.д. взаимодействия.
Молекулы, не обладающие сферической симметрией, характеризуются постоянными электрическими моментами.
Момент нулевого порядка - это полный заряд Qy а момент первого порядка - дипольный момент, являющийся векторной величиной:
![]()
Моменты более высоких порядков являются тензорными величинами. Электрические моменты различных молекул взаимодействуют между собой, не нарушая распределения зарядов.
Дипольные моменты молекул различаются очень сильно: дипольный момент м полярных молекул Н2 О равен 1.85 Д; молекул Н 33 - 1.47 Д, в то же время дипольные моменты молекул насыщенных углеводородов очень малы и проявляются только для определенных конформаций. Значения дипольных моментов некоторых небольших молекул приведены в табл.
Рассмотрим снова взаимодействие между двумя молекулами воды. В данном случае достаточно учитывать только электростатические взаимодействия в форме диполь-дипольного потенциала:
![]()
который для коллинеарного параллельного расположения диполей описывается выражением
![]()
где м = 1.85 Д и ![]() = 3 А. Для сравнения напомним, что квантово-механический расчет энергии взаимодействия для димера молекул воды дает величину около - 25 кДж/моль.
= 3 А. Для сравнения напомним, что квантово-механический расчет энергии взаимодействия для димера молекул воды дает величину около - 25 кДж/моль.
Постоянные дипольные моменты небольших молекул
| Молекула | Дипольный момент | Молекула | Дипольный момент |
| H2 O | 1.85 | Гексанол | 1.7 |
| NH3 | 1.47 | C6 H5 OH | 1.5 |
| СО | 0.11 | HCONH2 | 3.7 |
| CO2 | О | CH3 COCH3 | 2.9 |
| СНзОН | 1.7 | С2 ЩО | 1.9 |
| CH3 CH2 OH | 1.7 | C6 H5 NO2 | 4.2 |
Между двумя молекулами воды преобладает притяжение за счет диполь-ди-польного взаимодействия, в то время как в димерах диоксида углерода или бензола электростатическое взаимодействие обусловлено квадруполь-квадрупольным вкладом. Для нейтральных молекул характерны дипольные взаимодействия, которые дают наиболее значимый вклад в энергию взаимодействия. Важно отметить, что взаимодействия разных моментов характеризуются разными зависимостями от расстояния. Например, ион-ионное взаимодействие обратно пропорционально расстоянию между ионами, диполь-дипольное взаимодействие пропорционально r-3 , причем дополнительно оно обнаруживает сильную ориентационную зависимость. Квадруполь-квадрупольное взаимодействие спадает пропорционально r -5 , что объясняет малый вклад таких взаимодействий при ненулевом дипольном моменте. Позже мы увидим, что расстояние, на котором проявляется взаимодействие, сильно влияет на макроскопические характеристики.
Индукционные взаимодействия
Отдельно от электростатических сил в рамках классических представлений можно рассматривать явление индукции. В случае точечного диполя и нейтральной молекулы, не обладающей постоянным электрическим моментом, электрическое поле Eext диполя индуцирует небольшое перераспределение заряда в форме противоположно направленного дипольного момента:
![]()
Энергия индуцированного диполя задается взаимодействием индуцированного дипольного момента с приложенным полем за вычетом энергии, необходимой для создания диполя в поле. В индукционном взаимодействии участвует много тел, т.е. индуцированный дипольный момент зависит от всех постоянных, а также от всех индуцированных дипольных моментов.