Контрольная работа: Межмолекулярные взаимодействия
При анализе ионных взаимодействий с хорошим приближением можно рассматривать воду как диэлектрическую среду. Такой подход - это всего лишь примитивная модель, но он оказался краеугольным камнем в теории электролитов и в теории двойного электрического слоя. Одним из проявлений дальнодействия ионных взаимодействий является относительно низкая чувствительность KKM ионных ПАВ к типу противоиона. Например, замена иона натрия в качестве противоиона на ион тетраэтиламмония приводит к незначительному изменению KKM.
Значения KKM для додецилсульфатов с различными противоионами. Причина небольших изменений значений KKM - дальнодействие кулоновских взаимодействий
| ПАВ | ККМ, мМ |
| Ci2 SO4 " Na+ Ci2 SO4 " Li+ Ci2 SO4 -K+ Ci2 SO4 -N; C12 SO4 -N; | 8 9 8 6 5 |
Если обратиться к структуре мицелл, то очевидно, что электростатические взаимодействия препятствуют мицеллообразованию. Проявляется сильное отталкивание между отрицательно заряженными карбоксилатными группами на поверхности мицеллы. Тогда возникает вопрос: какие силы способствуют образованию мицелл? Конечно, определенную роль могут играть дисперсионные или индукционные взаимодействия, но они обычно невелики и по величине приблизительно одинаковы для взаимодействий молекул воды, молекул воды и ПАВ и ПАВ-ПАВ. Таким образом, эти силы не могут вызывать образование агрегатов молекул ПАВ.
Гидрофобные взаимодействия
Итак, нужно найти силы, ответственные за мицеллообразование. Как уже отмечалось, взаимодействие меду молекулами воды довольно сильное вследствие образования водородных связей. Введение неполярных молекул в воду оказывает сильное воздействие на сетку водородных связей, что приводит к уменьшению энергии взаимодействия. Энергетический проигрыш может быть минимизирован, если молекулы воды каким-то образом организуются вокруг молекулы растворенного вещества. Ценою этому будет проигрыш в энтропии. И свободная энергия переноса неполярной молекулы в воду при комнатной температуре будет определяться большим вкладом энтропии. При растворении неполярных молекул они будут стремиться минимизировать воздействие на сетку водородных связей за счет самоагрегирования. Рис. иллюстрирует силы притяжения между двумя атомами неона в воде. Притяжение возникает как результат эффектов сольватации. Сближение атомов неона вызывается растворителем. Притяжение между двумя атомами неона в газовой фазе характеризуется намного менее глубоким минимумом. На рис. показано, что замена одного из атомов неона на бесконечную гидрофобную стенку, как и следовало ожидать, приводит к еще большему притяжению в воде. Таким образом, можно сделать вывод о том, что гидрофобные взаимодействия обусловливают мицеллообразование.
Из табл. видно, что чем длиннее углеводородная часть молекул ПАВ, тем легче они агрегируют, о чем свидетельствуют более низкие значения ККМ. Гидрофобные взаимодействия могут быть достаточно сильными и являются результатом тонкого баланса энергетического и энтропийного вкладов. В настоящее время принято также считать, что гидрофобные взаимодействия являются главной движущей силой фолдинга молекул белков. Можно привести разные аргументы в пользу того или другого объяснения гидрофобных взаимодействий. Один из способов - допустить сильное когезионное взаимодействие между молекулами воды. Более того, эти взаимодействия чувствительны к ориентации, и любая попытка разрушить структуру приводит к изменению свободной энергии. В каком виде проявляется этот фактор - в энтропийной форме или энергетическом вкладе - это уже вторично. В случае неполярных молекул, например углеводородов, проигрыш в свободной энергии не может быть восполнен взаимодействием с молекулами растворенного вещества.
Простой способ оценки энергии переноса молекулы углеводорода из неполярного окружения в воду задается уравнением
![]()
где R - радиус молекулы растворенного вещества. Подобное выражение можно использовать для оценки гидрофобного взаимодействия между двумя контактирующими молекулами неполярных растворенных веществ:
![]()
где r - радиус молекулы воды.
Критическая концентрация мицеллообразования алкилсульфатов с различной длиной алкильной цепи.
Снижение KKM происходит вследствие гидрофобных взаимодействий между алкильными цепями
| ПАВ | ККМ, мМ |
| C8 SO4 " | 160 |
| CioSO4 | 40 |
| Ci2 SO4 " | 10 |
| Ci4 SO4 | 2.5 |

Моделирование гидрофобного эффекта методом Монте-Карло: а - свободная энергия гидратации для леннард-джонсовской частицы в воде. Параметр е принят постоянным и равным 0.62 кДж/моль; параметр у - варьируемая величина. Энтропийный и энергетический вклады показаны отдельно. б - Свободная энергия взаимодействия между двумя атомами неона в воде. Сплошная линия - то же для взаимодействия двух атомов неона в газовой фазе, в - Свободная энергия взаимодействия атома неона с гидрофобной стенкой в воде. Сплошная линия - взаимодействие двух атомов неона в воде. С разрешения AmericanInstituteofPhysics
Полуколичественной мерой способности растворителя растворять неполярные соединения является так называемый параметр Гордона, равный ![]() , где г - поверхностное натяжение растворителя, V - его молярный объем. У воды параметр Гордона очень высокий, а у гексана - очень низкий.
, где г - поверхностное натяжение растворителя, V - его молярный объем. У воды параметр Гордона очень высокий, а у гексана - очень низкий.
Эти данные подтверждают, что природа гидрофобных взаимодействий заключается в высокой плотности энергии когезии воды. Следует также отметить, что вода - более хороший растворитель, чем предсказывает параметр Гордона. Это означает, что вода до некоторой степени способна компенсировать проигрыш когезионной энергии при растворении неполярного вещества. Кроме того, гидрофобные взаимодействия можно качественно объяснить на основе теории регулярных растворов.
Таким образом, качественно роль гидрофобных взаимодействий при ассоциации поверхностно-активных веществ ясна, но описать эти взаимодействия количественно пока не представляется возможным. В отличие от гидрофобных взаимодействий эффективный потенциал взаимодействия между двумя ионами в растворе точно описывается уравнением.
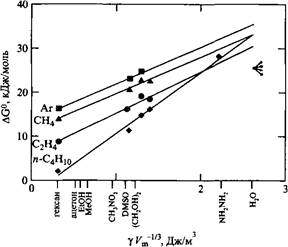
Зависимость свободной энергии переноса неполярного газа в растворители различной природы от параметра Гордона растворителя. Для большинства жидкостей энергия возрастает приблизительно линейно с увеличением параметра Гордона. В то же время для воды обнаружено значительное отклонение от такой зависимости. С разрешения JohnWiley & Sons, Inc.
Теория Дебая-Хюккеля
Растворы, содержащие заряженные частицы обладают особыми физико-химическими свойствами, что обусловлено дальнодействующим электростатическим потенциалом, спадающим с расстоянием г по закону г ~1 . Уже при небольших концентрациях электролита отчетливо проявляется неидеальность раствора. Добавки индифферентной соли сильно влияют на стабильность дисперсных систем, а также на скорости реакций и на кривые титрования. Различные электролиты существенно влияют на состояние ПАВ и полимеров в растворах. Например, введение индифферентного электролита в растворы ионных ПАВ заметно понижает величину KKM.
Таким образом, электростатические эффекты разнообразны и характерны для растворов. К счастью, качественно, а иногда и количественно в них можно разобраться на основе простой теории Дебая-Хюккеля.
Электростатический потенциал связан с распределением заряда уравнением Пуассона-Больцмана:
![]()
где Д - оператор Лапласа:

Задача сильно упрощается для сферически симметричных систем, поскольку в этом случае оператор Лапласа выражается соотношением
![]()
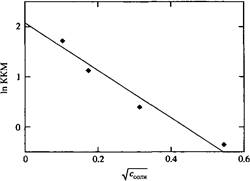
Влияние концентрации соли на ККМ. Прямая линия проведена с максимальным приближением к экспериментальным данным. Теория Дебая-Хюккеля предсказывает линейность между KKM и Соли.