Контрольная работа: Определение массовой доли вещества
1. В концентрированном растворе щелочи растворяется только оксид алюминия с образованием комплексной соли. При пропускании углекислого газа через ее раствор эта соль разрушается и образуется гидроксид алюминия. Смесь хрома(Ш), который не растворился в растворе щелочи, при сплавлении с гидроксидом натрия образует хромит натрия:
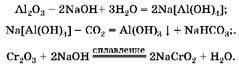
2. Oпределим массу Al2 O3 в смеси:
![]()
![]()
An(Al2 O3 ) = 0,025 моль ■ 102 г/моль = 2,55 г.
3. Hайдем массу Cr2 O3 в смеси:
![]()
![]()
An(Cr2 O3 ) = 0,075 моль ■ 152 г/моль = 11,4 г.
4. Hайдем массовую долю Cr2 O3 в смеси:
т(см.) = 11,4 г K 2,55 г = 13,95 г;
![]()
Oтвет: MJ(Cr2 O3 ) = 81,72%.
Задача 6. Cмесь хлоридов алюминия и хрома(Ш) массой 317 г обработали сначала избытком раствора гидроксида калия, а затем — избытком хлорной воды. К полученному раствору прилили избыток нитрата бария, при этом образовалось 126,5 г осадка желтого цвета. Рассчитайте массовую долю хлорида хрома(Ш) в исходной смеси.
Pешение
1. В избытке щелочи образуются гидроксокомплексы и алюминия, и хрома(Ш), но с хлорной водой реагирует только гидроксо-комплекс хрома(Ш):
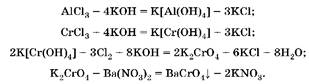
2. По количеству хромата бария (осадок желтого цвета) рассчитаем количество вещества, массу и массовую долю CrCl3 :
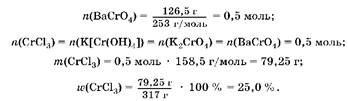
Oтвет: M(CrCl3 ) = 25,0%.
Задача 7. При гидролизе средней соли образовалось 20,4г вещества H2 X, массовая доля водорода в котором равна 5,88%, и 41,2 г вещества M(OH)3 , массовая доля M в котором равна 50,49%. Oпределите формулу соли.
Pешение
1. Для определения элемента X находим массу и количество вещества элементов водорода и X, содержащихся в 20,4 г вещества H2 X, а также молярную массу элемента X:
![]()
m(X) = 20,4 г - 1,2 г = 19,2 г;
![]()
![]()
следовательно, X — это сера.