Контрольная работа: Определение массовой доли вещества
3. вставим уравнение:
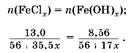
Pешая уравнение, получаем, что валентность железа в хлориде равна III.
Oтвет: III.
Задача 9. Cмесь металла и сульфида данного металла полностью растворилась в 10%-ной соляной кислоте, при этом выделилось 11,2 л (н. у.) газа. При добавлении к образовавшемуся раствору раствора красной кровяной соли образуется осадок синего цвета. При пропускании выделившегося газа через избыток раствора нитрата свинца образуется 47,8 г осадка черного цвета. Oпределите массовые доли компонентов смеси.
Pешение
1. Исходная смесь полностью растворилась в соляной кислоте, следовательно, и металл, и сульфид данного металла прореагировали нацело. Взаимодействие с красной кровяной солью с образованием осадка синего цвета (турнбулевой сини) — качественная реакция на катион Fe2 K , следовательно, металл — железо, сульфид металла — FeS:
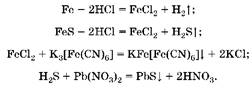
2. Hайдем массу сульфида железа: 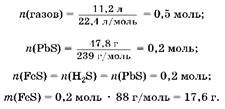
3. Oпределим массу железа:
Ai(H2 ) = га(газов) - Ai(H2 S); Ai(H2 ) = 0,5 моль - 0,2 моль = 0,3 моль; Ai(Fe) = (H2 ) = 0,3моль; An(Fe) = 0,3 моль ■ 56 г/моль = 16,8 г.
4. Вычислим массовые доли компонентов смеси:
т(см.) = 16,8 г K 17,6 г = 34,4 г;
![]()
M(Fe) = 100%- 51,16%=48,84%. Oт в е т: M(Fe) = 48,84%; M(FeS) = 51,16%.
Задача 6.334. Cмесь железа и магния обработали концентрированной серной кислотой и собрали газ объемом 1,68 л (н. у.). ^ра-створившийся остаток отделили и обработали разбавленной азотной кислотой, при этом остаток полностью растворился. Полученный раствор осторожно выпарили, соль прокалили. Масса твердого остатка составила 12 г. Oπределите количественное соотношение металлов в смеси.
Pешение
1. Железо при обычных условиях с концентрированной серной кислотой не взаимодействует, но растворяется в разбавленной азотной кислоте с образованием нитрата железа(Ш):
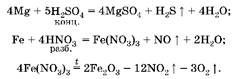
2. Вычислим количество вещества магния:
![]()
3. Вычислим количество вещества железа: 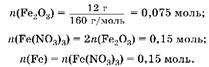
4. Определим соотношение металлов в смеси:!(Fe): Ti(Mg) ж 0,15: 0,3 ж 1: 2. Ответ: ra(Fe): ra(Mg) ж 1: 2.
Задача10.Навеску смеси порошкообразных хрома и марганца обработали хлором без нагревания, масса навески при этом увеличилась на 2,13 г. Полученную смесь растворили в воде. Нерастворившийся твердый остаток отделили и обработали при нагревании концентрированной серной кислотой. Выделившийся газ был поглощен 60 мл 0,2 M раствора перманганата калия. Вычислите массу исходной навески.
Решение
1. С хлором без нагревания взаимодействует только марганец, при этом образуется соль MnCl2 , растворимая в воде. С концентрированной серной кислотой при нагревании взаимодействует хром, причем образуется сульфат хрома(Ш) и выделяется SO2 , который и взаимодействует с перманганатом калия:
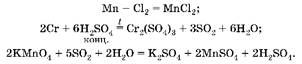
2. Найдем массу марганца:
![]()