Контрольная работа: Определение массовой доли вещества
3. Найдем массу хрома:
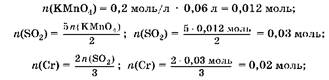
TO(Cr) ж 0,02 моль ■ 52 г/моль ж 1,04 г.
4. Вычислим массу исходной смеси:
то(см.) жTO(Cr) Kто(Мп); то(см.) ж 1,04 г K 1,65 г ж 2,69 г. Ответ: то(см.) ж 2,69 г.
Задача 11. При прокаливании смеси, содержащей равные количества вещества гидроксида, карбоната и нитрата двухвалентного металла, масса смеси уменьшилась на 25,5 г. Определите металл, входящий в состав соединений, а также массу смеси, если смесь не содержит примесей, а массовая доля металла в ней равна 46,83%.
Решение
1. Обозначим молярную массу металла через а количество вещества каждого компонента смеси — через Так как металл двухвалентен, а количества веществ в смеси равны, то масса металла равна 3,- (г).
Выразим массу исходной смеси:
то(исх. см.) жто(Me(OH)2 ) Kто(Me(NO3 )2 ) KTre(MeCO3 ); то(исх. см.) ж-(, K 34) K-(, K 124) K-(, K 60); то(исх. см.) ж 3,- K 218-.
2. Определим металл:
![]()
Решая это уравнение, получаем, ж 64, следовательно, металл — медь.
3. Напишем уравнения реакций:
(1) (2 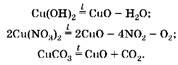 (3
(3
4. Найдем массу исходной смеси.
Так как масса смеси уменьшилась за счет образования газообразных продуктов реакции, то:
о(исх. см.) жо(кон. см.) K 25,5;
то(исх. см.) ж- ■ 98 K- ■ 188 K- ■ 124; то(исх. см.) ж 410-;
то(кон. см.) жTO1 (CuO) K To2 (CuO) K To3 (CuO);
Следовательно, в смеси было по 0,15 моль веществ. Найдем ее массу:
то(исх. см.) ж 0,15 ■ 410 ж 61,5 (г). Ответ: Cu; то(исх. см.) ж 61,5 г.
Задача 12. Hитрат неизвестного металла растворили в воде и полученный раствор разделили на две равные части. К одной части добавили магний, к другой — такую же массу марганца. По окончании реакции масса осадка во второй части оказалась на 3,1 г меньше, чем в первой. После добавления избытка соляной кислоты к обоим осадкам они частично растворились, и их массы оказались равными и составили 21,6 г. Oπределите неизвестный металл.
Pешение
1. Hадо учесть, что осадки — это неизвестный металл, вытесненный из соли магнием и марганцем, который, в отличие от магния и марганца, не растворяется в соляной кислоте:
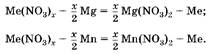
2. Так как массы осадков равны, то одинаково и количество вещества металла, а, следовательно, равны и количества вещества вступивших в реакцию магния и марганца.
Если прореагирует 1 моль магния и 1 моль марганца, то разность масс осадков будет равна Дт = 55 г -24 г = 31 г. Так как разность масс осадков равна 3,1 г, следовательно, в реакцию вступило 0,1 моль Mg и 0,1 моль Mn. Cогласно уравнениям реакций образовалось по 0,2 моль неизвестного металла. Hайдем его молярную массу:
![]() = 108 г/моль, металл — серебро. Oт в е т: Ag.
= 108 г/моль, металл — серебро. Oт в е т: Ag.