Контрольная работа: Определение массовой доли вещества
![]()
то(М) ж41,2 г 0,5049 ж 20,8 г.
3. Так как количество вещества элемента М и количество вещества M(OH)3 равны, то составим уравнение и определим элемент М, обозначив его молярную массу через
![]()
Решая уравнение, находим, что - = 52 г/моль, следовательно, элемент М — это хром.
4. Для определения формулы соли необходимо знать количество вещества элементов серы и хрома:
![]()
следовательно, формула соли Cr2 S3 . Ответ: Cr2 S3 .
Задача 7. Газ, образовавшийся при разложении дихромата аммония массой 126 г, смешали с газом, выделившимся при растворении 42 г гидрида натрия в 900 мл 2 M раствора хлороводорода, и пропустили при соответствующих условиях над никелевым катализатором. Продукт реакции растворили в избытке раствора азотной кислоты. Рассчитайте, насколько увеличится масса раствора азотной кислоты.
Решение
1. Масса азотной кислоты увеличивается за счет поглощения аммиака, который образуется при соответствующих условиях из водорода и азота:
(1) (2)
(3) 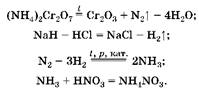 (4)
(4)
2. Найдем количество вещества азота:
![]()
3. Определим количество вещества водорода:
![]()
ra(HCl) ж 2 моль/л 0,9 л ж 1,8 моль — избыток, значит, количество вещества водорода определяем по NaH:
ra(H2 )ζ ra(NaH) ж 1,75 моль.
4. Сравним количество вещества N2 и H2 . По уравнению:
![]()
а имеем 0,5 моль, следовательно, азот прореагирует полностью.
5. Вычислим массу аммиака:
ra(NH3 )ζ 2ra(N2 )ζ 1моль; то(NH3 )ζ 1 моль ■ 17 г/моль ж 17 г — на столько увеличится масса раствора азотной кислоты. Ответ:![]() ж 17 г.
ж 17 г.
Задача 8. К раствору хлорида железа, содержащему 13,0 г соли, прибавили избыток гидроксида калия. При этом образовался осадок массой 8,56 г. Определите валентность железа в хлориде.
Решение
1. Известны нераствормые гидроксиды железа(11) и железа(Ш). Обозначим валентность железа в хлориде через,:
![]()
2. Выразим через & количество вещества соли и гидроксида железа: