Курсовая работа: Оксикислоти

Оксикислоти, вступаючи в реакції як спирти, утворюють алкоголяти, прості ефіри, заміщують гідроксил на галоген. Так, при взаємодії оксикислот з лужними металами, лугами спочатку утворюються солі цих кислот, які далі реагують з цими ж речовинами і дають алкоголяти:

При дії на оксикислоти галогеноводнів спиртовий гідроксил їх молекул заміщується на галоген і утворюються відповідні галогенокислоти:


Оксикислоти, подібно до спиртів, можуть окислюватись. Ця властивість оксикислот відрізняє їх від карбонових кислот, які, як правило, стійкі до окислення. Оксикислоти, що містять первинну ОН-групу, при окисленні перетворюються на альдегідокислоти, а оксикислоти з вторинною ОН-групою - на кетокислоти:

Аналогічне окислення молочної кислоти до піровиноградної відбувається і в живих організмах.
Крім реакцій, які відбуваються з участю карбоксильної і спиртової груп, оксикислотам властиві також специфічні реакції, зумовлені взаємним впливом двох функціональних груп у їх молекулах. Так, α-,β-,γ-, δ-, і ε-оксикислоти по-різному перетворюються при нагріванні. Оксикислоти при підвищених температурах дегідруються. Але залежно від взаємного розміщення спиртової і карбоксильної груп дегідратація їх проходить по-різному і з утворенням різних продуктів реакції.
α-Оксикислоти при нагріванні відщеплюють воду міжмолекулярно за рахунок гідроксилу карбоксильної групи однієї молекули оксикислоти і атома водню спиртової групи другої молекули оксикислоти. Продуктами такої дегідратації є циклічні міжмолекулярні складні ефіри, які називають лактидами. Так, гліколева кислота за таких умов дає кристалічний лактид 2,5-діоксо-1,4-діоксан, або гліколід (Тпл = 86ºС):

Молочна кислота при дегідратації утворює лактид 3,6-диметил-2,5-діоксо-1,4-діоксан:
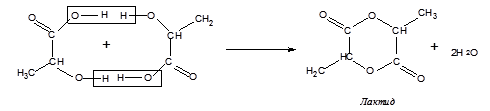 β -
β -
Оксикислоти при нагріванні дегідрауються внутрішньомолекулярно. Вода при цьому відщеплюється за рахунок спиртового гідроксилу і α-водневого атома метиленової групи. В результаті утворюються α-, β-ненасичені кислоти. Так, β-оксипропіонова кислота при цьому перетворюється на акрилову кислоту:
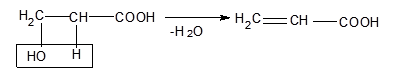
γ - і δ-Оксикислоти при нагріванні вступають у внутрішньомолекулярну етерифікацію між спиртовим гідроксилом і карбоксильною групою, утворюючи внутрішньомолекулярні циклічні складні ефіри, які називають лактонами. Так, γ-оксимасляна кислота при дегідратації перетворюється на бутиролактон (Ткип = 204°С):
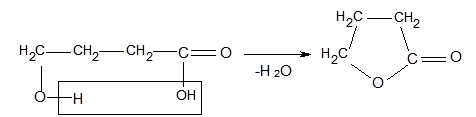
Реакцію лактонізації оксикислот відкрив у 1873 р.О.М. Зайцев. Лактони є біологічно активними речовинами і використовуються для синтезу замінників крові. Деякі лактони мають приємний запах і їх застосовують у парфюмерії.
ε-Оксикислоти і оксикислоти з ще більш віддаленою спиртовою групою при нагріванні вступають у реакції конденсації і утворюють при цьому лінійні полімери.
Гідроліз диефіру оксикислоти, каталізуємий як кислотами, так і лугами, приводить до розщеплення тільки скланоефірної групи. При взаємодії оксикислот з ангідридами або хлорангідридами кислот відбувається реакція ацилірування спиртової гідроксигрупи з утворенням відповідного складного ефіру, а карбоксильна група при цьому зберігається.
Спиртову гідроксигруппу оксикислоти можна окислити в карбонільну групу одним з окислювачів, використовуваних звичайно для окислювання спиртів, наприклад хромовою кислотою, і, навпроти, карбоксильну групу можна відновити в спиртову групу дією алюмогидріду літію. Молочна кислота при взаємодії з йодистоводородною кислотою відновлюється в пропіонову кислоту.
П'ятихлористий фосфор заміщує на галоген одночасно як спиртовий гідроксил, так і гідроксил карбоксилу молекули оксикислоти і перетворює їх таким чином на хлорангідриди хлорорганічних кислот:
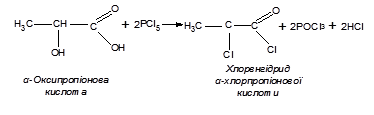
Залежно від взаємного розташування гідроксильної й карбоксильної групи оксикислоти здатні перетерплювати різні хімічні трансформації при нагріванні. Так, α-оксикислоти при нагріванні легко розщеплюються з утворенням альдегідів (реакція декарбонілюрування). Механізм цієї реакції включає протонірування гідроксигруппи карбоксильного угрупування, відщіплення молекули води з утворенням порівняно стійкого ацилий-катіона, відщіплення молекули СО і наступне депротонірування катіона А, що приводить до утворення альдегіду. Легкість протікання цієї реакції зв'язана в основному з тим, що катіон А стабілізований мезомерним ефектом гетероатома.
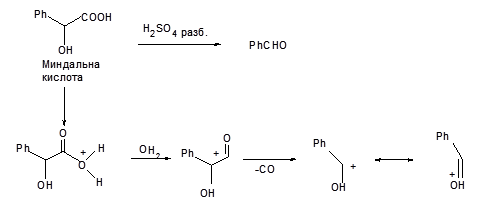
Характерною рисою оксикислот є утворення складних ефірів у результаті взаємодії двох функціональних груп, що входять до складу молекули. Так, α-оксикислоти при нагріванні утворять циклічний складний диэфір - лактид у результаті взаємодії спиртової групи однієї молекули з карбоксильною групою іншої.
|

|
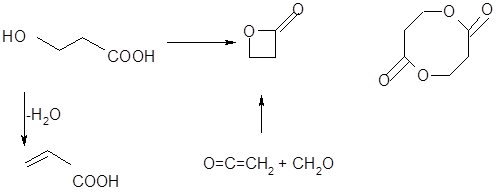
У тих же умовах β-оксикислоти подібно спиртам перетерплюють дегідратацію з утворенням α, β-ненасичених - акрилових кислот. Утворення β-лактонів не відбувається внаслідок малої стійкості чотиричленного циклу, а міжмолекулярна диєтеріфікація з утворенням восьмичленного циклу також не реалізується, можливо, внаслідок малої ймовірності необхідного взаємного просторового розташування функціональних груп на стадії замикання циклу (ентропійний фактор). Слід зазначити, що, хоча β-лактони й не утворяться при дегідратації β-оксикислот, вони проте відомі й можуть бути отримані, наприклад, взаємодією кетена з формальдегідом. Для γ-оксикислот характерна схильність до утворення внутрімолекулярного складного ефіру настільки велика, що γ-лактони можуть утворюватися вже при підкисленні водяних розчинів солей цих кислот, незважаючи на присутність великого надлишку води.
|