Курсовая работа: Определение термодинамических активностей компонентов бронзы БрБ2
Обобщённая диаграмма системы бериллий – никель, построенная по результатам работ многих исследователей, приведена на рисунке 1.6.
В сплавах системы образуются две промежуточные фазы переменного состава на основе соединений NiBe и Ni5 Ве21 , указанные фазы плавятся конгруэнтно при 1472 и 1264°С, соответственно. В сплавах кристаллизуются три эвтектики (Ni) + NiBe, NiBe + Ni5 Be21 и Ni5 Be21 + (β-Ве) при температурах 1157, 1190 и 1240°С, эвтектические точки расположены при содержаниях 23,6; 68,5 и 89% (ат.) Be, соответственно. При температуре 1065°С протекает эвтектоидный распад β-Ве на смесь α-Вс + Ni5 Be21 .

Рис. 1.6 Диаграмма состояния Be-Ni
Эвтектоидная точка расположена при 91,8% (ат.) Be. При температуре 800°С область гомогенности фазы на основе NiBe имеет протяженность около 4% (ат.), а на основе Ni5 Be21 — около 5%(ат.). Ni один из немногих элементов, который значительно снижает температуру полиморфного превращения β-Ве↔α-Ве.
Для растворимости Ni в Be (по данным разных авторов) указаны следующие значения: 5, 4 и 3% (ат.) при температурах 1080, 600 и 500°С, соответственно, а для растворимости Be в Ni: 15,3; 11,7; 7,3; 3,7 и 1,8% (ат.) при температурах 1150, 1000, 800, 600 и 440°С, соответственно. Методом вторичной ионной эмиссии растворимость Ni в Beопределена равной 1,3±0,27%(ат.) при 20°С.
Соединение NiBe(β-фаза) обладает структурой типа CsCl (группа симметрии ![]() ) с параметром элементарной ячейки (при 49,8% (ат.) Ni) а =0,2604÷0,2631 нм. Соединение Ni5 Be21 имеет деформированную решетку типа γ-латуни (группа симметрии
) с параметром элементарной ячейки (при 49,8% (ат.) Ni) а =0,2604÷0,2631 нм. Соединение Ni5 Be21 имеет деформированную решетку типа γ-латуни (группа симметрии ![]() ) с параметром псевдокубической ячейки а = 0,758 нм при содержании 81,9—82,5% (ат.) Ве.
) с параметром псевдокубической ячейки а = 0,758 нм при содержании 81,9—82,5% (ат.) Ве.
1.3Диаграмма состояния Cu–Ni [3, c. 283-284].
Диаграмма состояния медь – никель приведена на рисунке 1.7.
В интервале температур 1000—1500°Сисследование проведено с использованием катодной Сu чистотой 99,99%(по массе) и электролитического Ni чистотой 99,95% (по массе) методом микрорентгеноспектрального анализа образцов, закаленных из твердожидкого состояния. Результаты работы хорошо совпадают с данными,

Рис. 1.7 Диаграмма состояния Cu - Ni
полученными методами термического, металлографического и микрорентгеноспектрального анализов в области концентраций 0-100% (ат.) Ni. Система Сu—Ni характеризуется образованием в процессе кристаллизации непрерывного ряда твердых растворов (Си, Ni) с гранецентрированной кубической структурой. По данным спектрального анализа установлено равновесие Ж↔Г с азеотропным минимумом при температуре 2500°С и концентрации 50—60% ; (ат.) Ni; указывается на наличие области расслоения на две фазы (газообразный и жидкий растворы разного состава) при концентрации 60—100% (ат.) Ni. В интервале концентраций 0—60%(ат.) Ni область расслоения настолько узка, что практически вырождается в прямую линию.
Граница расслаивания твердого раствора и критическая точка несмешиваемости, соответствующая концентрации никеля 69,7% (ат.) и температуре 342°С приведена на основании расчета, проведенного по термодинамическим константам.
1.4Термодинамическое моделирование свойств твёрдых металлических растворов [4, c. 17-20]
Существует 2 способа описания термодинамических свойств растворов – с помощью активностей компонентов и с помощью избыточных термодинамических функций. Эти способы тесно связаны между собой.
Избыточная термодинамическая функция – это положительный или отрицательный избыток какого-либо термодинамического свойства реального раствора над тем же свойством гипотетического идеального раствора при одинаковых значениях параметров. Обозначают их верхними индексами Е.
Если в качестве стандартного состояния выбрать чистый компонент, и концентрации представлять в виде мольных долей, то для компонента s:
![]() (1.1)
(1.1)
Коэффициент активности ![]() может быть выражен через соответствующий избыточный химический потенциал:
может быть выражен через соответствующий избыточный химический потенциал:
 (1.2)
(1.2)
Прологарифмировав (1.1) с учётом (1.2) получим:
![]() (1.3)
(1.3)
Таким образом, для определения активности необходимо знать избыточный химический потенциал (или избыточную энергию Гиббса), а для аналитического представления концентрационной и температурной зависимости термодинамических свойств растворов нужно знать соответствующую зависимость ![]() или
или ![]() .
.
Обычно для описания реальных растворов применяют модель идеального раствора, при этом ![]() . Однако, в реальном растворе законы Рауля и Генри, а также равенства типа
. Однако, в реальном растворе законы Рауля и Генри, а также равенства типа ![]() (или
(или ![]() ) выполняются только в чрезвычайно узких диапазонах концентраций при
) выполняются только в чрезвычайно узких диапазонах концентраций при ![]() →0, или
→0, или ![]() →1 (то есть в бесконечно разбавленных растворах).
→1 (то есть в бесконечно разбавленных растворах).
Существует теория, включающая в себя понятия «идеальный» и «предельно разбавленный» растворы, как частные случаи. Это обобщённая теория «регулярных» растворов (далее – ОТРР). С её позиций области, в которых реальный раствор является регулярным (так называемые области «граничной регулярности») располагаются также по краям диапазона концентраций, но они существенно шире.
Регулярным называется модельный раствор, при образовании которого может выделяться или поглощаться теплота, но не изменяется объём, а энтропия смешения компонентов которого равна энтропии смешения идеальных газов.
Для регулярного раствора, состоящего из m компонентов, в рамках ОТРР выполняется соотношение:
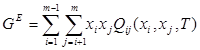 (1.4)
(1.4)