Курсовая работа: Определение термодинамических активностей компонентов бронзы БрБ2
Если в ![]() отдельно выделить концентрационно зависимую составляющую и разложить её в ряд Тейлора, то получится уравнение:
отдельно выделить концентрационно зависимую составляющую и разложить её в ряд Тейлора, то получится уравнение:
![]() (1.5)
(1.5)
При этом каждое из слагаемых в правой части будет зависеть от температуры.
Как показывает математическая обработка экспериментальных данных, для бинарных растворов достаточно первых трёх параметров ![]() , чтобы в большинстве случаев корректно аппроксимировать термодинамические функции смешения системы. При этом
, чтобы в большинстве случаев корректно аппроксимировать термодинамические функции смешения системы. При этом ![]() - энергия смешения компонентов i и j в растворе на основе компонента i,
- энергия смешения компонентов i и j в растворе на основе компонента i,![]() - энергия смешения компонентов i и j в растворе на основе компонента j. Обе эти величины – это термодинамические характеристики областей граничной регулярности двойной системы. А
- энергия смешения компонентов i и j в растворе на основе компонента j. Обе эти величины – это термодинамические характеристики областей граничной регулярности двойной системы. А ![]() - это параметр, учитывающий отклонение от регулярности вне этих областей.
- это параметр, учитывающий отклонение от регулярности вне этих областей.
В рамках данной работы принято считать растворы регулярными во всём диапазоне концентраций и принимать ![]() =0. С учётом этого, выражение для химического потенциала компонента s в растворе, содержащем m компонентов, запишется так:
=0. С учётом этого, выражение для химического потенциала компонента s в растворе, содержащем m компонентов, запишется так:
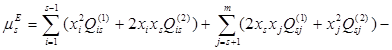
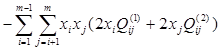 (1.6)
(1.6)
Формулы ОТРР позволяют успешно описывать термодинамические свойства металлических, неметаллических и смешанных систем.
2. Расчётная часть
Как уже было сказано ранее, бериллиевая бронза БрБ2 содержит в своём составе (по массе) 97,5% Cu, 0,5% Ni, 2% Be.
Если условно обозначить медь, как компонент 1, никель, как компонент 2 и бериллий, как компонент 3, то можно для каждого компонента этой тройной системы переписать уравнение (1.3), подставив в него уравнение (1.6) в следующем виде:
![]()
![]()
![]() (2.1)
(2.1)
![]()
![]() (2.2)
(2.2)
![]()
![]() (2.3)
(2.3)
Для определения активностей компонентов бронзы при 25°С необходимо установить температурные зависимости энергий смешения Q в низкотемпературном интервале. Для этого можно использовать диаграммы состояния бинарных систем.
Для систем Be – Cu и Be – Ni такие зависимости были получены предшествующими исследователями. В данной работе будет выполнен анализ зависимостей для системы Cu – Ni.
2.1 Расчёт зависимости энергий смешения компонентов системы Cu – Ni от температуры
Рассмотрим низкотемпературную часть диаграммы Cu – Ni (см. рис. 1.7). Ниже линии солидуса образуется ряд непрерывных твёрдых растворов с решёткой ГЦК. Однако при температурах ниже 342°С наблюдается купол расслаивания на твёрдый раствор на основе меди (обозначим его, как α-фазу) и твёрдый раствор на основе никеля (обозначим его, как γ-фазу). Внутри купола находится смесь этих фаз.
На границе купола α-фаза находится в равновесии с γ-фазой. Это можно записать следующими уравнениями:
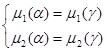 (2.4)
(2.4)
Для любого из компонентов 1 и 2 и в α- и в γ-фазе справедливо соотношение:
![]() (2.5)
(2.5)
Обе фазы имеют одинаковую структуру (ГЦК). Это можно объяснить высоким сродством меди и никеля. На диаграмме состояния (рис. 1.7) видно, что сплав плавится конгруэнтно во всём диапазоне концентраций. Более того, линии ликвидуса и солидуса расположены очень близко друг к другу, то есть плавление происходит почти в изотермических условиях, как у чистого металла. Аналогично происходит и испарение сплава.
На основании этого можно записать, что:
![]() (2.6)
(2.6)