Курсовая работа: Определение термодинамических активностей компонентов бронзы БрБ2
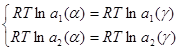 (2.7)
(2.7)
Обозначим через х мольные доли компонентов в α-фазе, а через N – мольные доли компонентов в γ-фазе, и учитывая условия нормировки их на единицу, можно систему уравнений (2.7) с учётом (1.3) и (1.6) переписать в следующем виде:
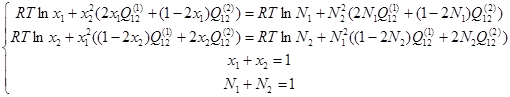 (2.8)
(2.8)
Если бы были известны мольные доли x и N при 25°С, то можно было бы с помощью (2.8) непосредственно вычислить значения Q при этой температуре. Однако при столь низкой температуре невозможно получить экспериментальных данных о координатах купола расслаивания. Дело в том, что наступление равновесия между фазами происходит, благодаря диффузии атомов, а в комнатных условиях она протекала бы экстремально долго (несколько сотен лет). Поэтому необходимо изучить температурную зависимость энергий смешения и экстраполировать её на уровень комнатных температур.
Если T=const и известны все x и N, то система уравнений (2.8) линейна относительна параметров Q и может быть решена аналитически.
Обозначим ![]() . Если теперь перенести правую часть системы (2.8) в левую, то она перепишется в виде:
. Если теперь перенести правую часть системы (2.8) в левую, то она перепишется в виде:
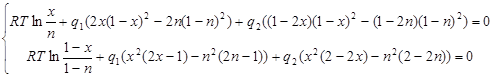 (2.9)
(2.9)
Выразим ![]() из первого уравнения системы (2.9):
из первого уравнения системы (2.9):
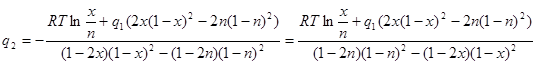 (2.10)
(2.10)
Подставим (2.10) во второе уравнение системы (2.9):
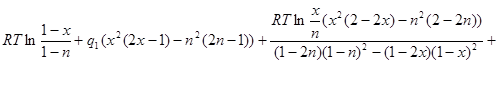
![]() (2.11)
(2.11)
Теперь можно выразить в явном виде величину ![]() :
:
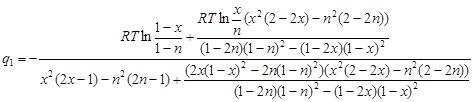 (2.12)
(2.12)
Теперь приведём выражения в числителе и знаменателе дроби (2.12) к общему знаменателю:
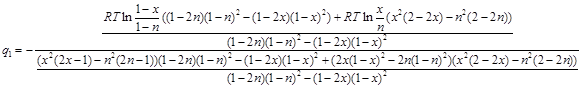
(2.13)
Умножив числитель и знаменатель дроби (2.13) на выражение ![]() , окончательно получим:
, окончательно получим:
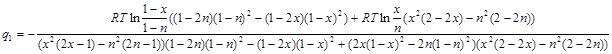
(2.14)
Система уравнений (2.9) не имеет степеней свободы, поэтому случайная погрешность отсутствует. Возможно, пользуясь законом накопления ошибок, определить систематическую погрешность и рассчитать доверительный интервал для значений Q. В данной работе это не учитывается.
Координаты купола расслаивания при различных температурах были сняты с диаграммы состояния Cu – Ni (рис. 1.7) и представлены в таблице 2.1.
Табл. 2.1. Координаты купола расслаивания твёрдого раствора при разных температурах.
| t, o C | Состав α-фазы (Cu) | Состав γ-фазы (Ni) | ||
| x1 | x2 | N1 | N2 | |
| 200 | 0,650 | 0,350 | 0,013 | 0,987 |
| 225 | 0,633 | 0,367 | 0,027 | 0,973 |
| 250 | 0,580 | 0,420 | 0,053 | 0,947 |
| 275 | 0,513 | 0,487 | 0,073 | 0,927 |
| 300 | 0,467 | 0,533 | 0,113 | 0,887 |
| 325 | 0,387 | 0,613 | 0,187 | 0,813 |
| 342 | 0,300 | 0,700 | 0,300 | 0,700 |
Для каждой из температур были проведены вычисления значений энергий смешения. ![]() вычислены по формуле (2.14), ?
вычислены по формуле (2.14), ?