Курсовая работа: Равновесные и поляризационные диаграммы потенциал-pH
Ртутно-оксидный электрод: Hg2 O+2e- +H2 O=2Hg+2OH-
![]() (1.2.8)
(1.2.8)
Во всех системах, отвечающих электродам 1 и 2-ого, одним из компонентов восстановленной формы служит металл электрода. Если же инертный металл электрода не участвует в полуреакциях, а является только передатчиком электронов между Ox и Red, то такие системы называют окислительно-восстановительными электродами или редокс-системами.
Например, система:
Fe3+ +e- =Fe2+ , 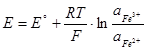
Cu2+ +e- =Cu+ , 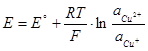
С платиновым электродом в качестве инертного переносчика электронов между Ox и Red.
Среди окислительно-восстановительных электродов выделяют газовые электроды. Газовый электрод состоит инертного металла (часто платины или платинированной платины), к которому подводится электрохимически активный газ. Молекулы газа адсорбируются на поверхности металла, распадаясь при этом на атомы, а адсорбированные атомы участвуют уже непосредственно в электродной реакции. Поскольку между молекулами газовой фазы и адсорбированными атомами устанавливается равновесие, то при записи электродного равновесия промежуточное адсорбционное состояние часто опускают. Примером газового электрода, обратимого по катиону, является водородный электрод, на поверхности которого устанавливается равновесие: H+ +e- =1 /2 H2 .
Потенциал водородного электрода – это ЭДС цепи:
Pt, H2 (p=1)│H3 O+ (![]() =1) ¦¦ H3 O+ (
=1) ¦¦ H3 O+ (![]() )│ H2 (p), Pt
)│ H2 (p), Pt
Если в правой части цепи положить ![]() =1 и
=1 и ![]() , то цепь окажется полностью симметричной и ее ЭДС должна равняться нулю. Следовательно,
, то цепь окажется полностью симметричной и ее ЭДС должна равняться нулю. Следовательно,
![]() (1.2.9)
(1.2.9)
Классификация электрохимических цепей.
Электрохимические цепи обычно классифицируют по двум признакам:
1) по источнику электрической энергии
2) по наличию или отсутствию в цепи границы двух различных растворов: соответственно цепи с переносом и без переноса.
В физических цепях источником электрической энергии служит различие в физическом состоянии двух одинаковых по своему химическому составу электродов. Эти электроды погружены в один и тот же раствор и при работе цепи электрод, находящийся в менее устойчивом состоянии, переходит в более устойчивое состояние.
Физические цепи – цепи без переноса – подразделяются на аллотропические и гравитационные.
Аллотропические цепи – это цепи, в которых менее устойчивое состояние одного электрода обусловлено тем, что он изготовлен из метастабильной модификации данного металла.
Гравитационные цепи были впервые реализованы русским электрохимиком Р. А. Колли (1875). Например, гравитационная цепь, состоящая из двух ртутных электродов в растворе Hg2 (NO3 )2 . Ее левый электрод с более высоким уровнем ртути обладает большим запасом потенциальной энергии по сравнению с правым электродом. Этот избыток потенциальной энергии в расчете на 1 г-экв металлической ртути составляет ![]() , где
, где ![]() - молекулярная масса ртути;
- молекулярная масса ртути; ![]() - ускорение силы тяжести;
- ускорение силы тяжести; ![]() - разность уровней ртути. При работе цепи на левом электроде происходит растворение ртути;
- разность уровней ртути. При работе цепи на левом электроде происходит растворение ртути;
Hg→![]() Hg
Hg![]() +e-
+e-
а на правом, наоборот, разряд ионов Hg![]() :
:
![]() Hg
Hg![]() +e- →Hg
+e- →Hg
В результате этих двух электродных процессов происходит перенос металлической ртути из левой части в правую, который направлен на выравнивание уровней ртути. При этом перенос 1 г-экв ртути соответствует прохождению через систему 1 фарадея и электрической работе EF. Поскольку источником этой энергии является потенциальная энергия ![]() , то ЭДС гравитационной цепи равна:
, то ЭДС гравитационной цепи равна:
![]() (1.2.10)
(1.2.10)
Из-за малых величин Е гравитационные цепи не имеют практического значения. Они представляют интерес как пример, иллюстрирующий законы превращения энергии.
В концентрационных цепях оба электрода идентичны как по физическому состоянию, так и по химической природе участников окислительно-восстановительных процессов; они отличаются только концентрацией компонентов Ox или Red. Источником электрической энергии является разность свободных энергий Гиббса, обусловленная различными активностями одних и тех же химических компонентов. Концентрационные цепи можно приготовить из амальгам разных концентраций в одном и том же растворе; из одинаковых электродов 1 или 2-ого рода, находящихся в растворах разной концентрации; из одинаковых газовых электродов, работающих при разных давлениях газов.
Различают концентрационные цепи без переноса, т.е. без границы двух растворов, и с переносом, когда имеется такая граница. Цепи, построенные из двух амальгамных электродов с разной концентрацией амальгам или из двух газовых электродов с разным давлением газа, содержат всего один раствор, а потому представляют собой цепи без переноса. В этих цепях на электроде с большей концентрацией амальгамы или с большим давлением газа происходит ионизация атомов амальгамы или газа, а на электроде с меньшей концентрацией амальгамы (с меньшим давлением газа) идут обратные процессы образования амальгамы или газа. Таким образом, в результате работы концентрационной цепи происходит выравнивание активностей компонентов на обоих электродах. В качестве примера можно рассмотреть следующую амальгамную цепь:
Pt│Zn (Hg)│ZnSO4 │Zn (Hg)│Pt