Курсовая работа: Специфичность фермента амилазы
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
1.2. АМИЛАЗЫ СТРОЕНИЕ, ФУНКЦИИ
1.3 СПЕЦИФИЧНОСТЬ АМИЛАЗЫ
1.4. ВЛИЯНИЕ ИНГИБИТОРОВ И АКТИВАТОРОВ НА АКТИВНОСТЬ АМИЛАЗЫ
2. ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
3. ЗАКЛЮЧЕНИЕ
4. ?????? ???????????? ?????????????????? ????? ?? ??????????????? ???????, ??? ????????, ??? ? ????? ???????? ??????? ?????????.???????? ????????? ????? ??????? ???????? ??? ????? ??????? ??????????, ??????? ? ???????????????? ??????????????, ??????? ????????????? ???????????? ???????? ??????? ??? ???????? ? ????????? ?????????. ??????? ????? ?? ???????? ??????? ????? ???????? ???????? ??????? ?????????.
Актуальность работы: амилазы широко используются в пищевой промышленности. Так амилазы используются в хлебопечении и технологиях брожения. Также амилаза играет значительную роль в расщеплении крахмала в организме человека. Поэтому понимание действия амилазы важно для оптимизации промышленного производства и изучения обмена веществ в организме человека.
Цель: данной работы рассмотреть специфичность действия амилазы.
? ?????? ?????????? ???????????? ???? ?????????? ??????????? ????????? ??????:1. ??????? ????????????? ?????????.2. ????????? ???????? ? ??????? ???????? ???????.3. ??????? ????????????? ???????? ???????? ???????.4.??????????? ??????? ??????????? ? ??????????? ?? ?????????? ???????.1. ???????????? ?????
1.1 КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
Современная классификация ферментов разработана в 1961 г. Комиссией по ферментам Международного биохимического союза. В основу классификации положен тип катализируемой реакции, которая является специфичным для каждого фермента.
Согласно этой классификации все ферменты делят на 6 главных классов:
1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции;
2. Трансферазы – катализируют реакции межмолекулярного переноса групп атомов и радикалов;
3. Гидролазы – катализируют реакции расщепления при участии воды;
4. Лиазы – катализируют реакции внутримолекулярного негидролитического расщепления, с образованием двойной связи или присоединения по двойной связи;
5. Изомеразы – катализируют реакции изомеризации;
6. Лигазы (синтетазы) – катализируют реакции синтеза с затратой энергии.
Оксидоредуктазы.
К классу оксидоредуктаз относят ферменты, катализирующие реакции окисления-восстановления. Общая схема может быть представлена следующим образом:
![]()
Окисление протекает как процесс отнятия атомов Н (электроном от субстрата, а восстановление – как присоединение атомов Н (электронов) к акцептору. Если обозначить рецептор буквой А, а субстрат В, то уравнение реакции окисления–восстановления при участии оксидоредуктаз примет такой вид:
![]()
В природных объектах обнаружено около 500 индивидуальных оксидоредуктаз. Наиболее распространены оксидоредуктазы, содержащие в качестве активной группы никотинамидадениндинуклеотид, или НАДН+. Их принято называть дегидрогеназами.
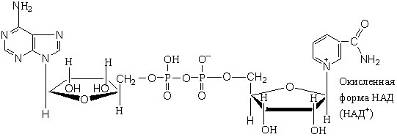
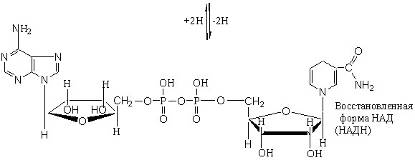
Число известных процессов окисления спиртовых групп до карбонильных с помощью никотинамидных коферментов превышает две сотни. Например, важный промежуточный этап окисления глюкозы – это окисление глицеральдегид-3-фосфата, который протекает по реакции и приводит к образованию смешанного ангидрида 3-фосфоглицериновой кислоты и ортофосфорной кислоты – 1,3-дифосфоглицерата.
![]()
--> ЧИТАТЬ ПОЛНОСТЬЮ <--