Реферат: Фізика атомів і молекул
План
1. Використання рівняння Шредінгера до атома водню. Хвильова функція. Квантові числа.
2. Енергія атома водню і його спектр. Виродження рівнів. Правила відбору.
3. Механічний і магнітний моменти атома водню.
1. Використання рівняння Шредінгера до атома водню. Хвильова
функція. Квантові числа
Теорія Бора будови й властивостей енергетичних рівнів електронів у водневоподібних системах знайшла своє підтвердження у квантовій механіці. Квантова механіка також стверджує, що:
a) електрони в атомах водню знаходяться лише в дискретних енергетичних станах. При переході електронів з одних станів в інші випромінюється або поглинається фотон;
б) не існує певних колових орбіт електронів. В силу хвильової природи електрони «розмиті» в просторі подібно до хмарки негативного заряду. Розміри й форму такої хмарки в заданому стані можна розрахувати.
Розглянемо рух електрона в кулонівському полі ядра із зарядом Ze , потенціальна енергія якого виражається формулою
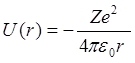 , (1)
, (1)
де r – відстань між електроном і ядром.
Стан електрона в атомі водню або водневоподібному атомі описується деякою хвильовою функцією , яка задовольняє стаціонарне рівняння Шредінгера:
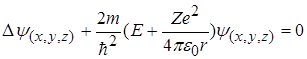 , (2)
, (2)
де 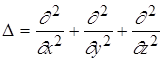 ― оператор Лапласа; Е ― значення повної енергії електрона в атомі; m ― маса частинки;
― оператор Лапласа; Е ― значення повної енергії електрона в атомі; m ― маса частинки; ![]()
![]() (x,y,z) ― хвильова функція у декартовій системі координат.
(x,y,z) ― хвильова функція у декартовій системі координат.
Для розв’язування рівняння Шредінгера (2), тобто знаходження виду хвильової функції для електрона в атомі водню слід перейти від декартових координат до сферичних. У цьому випадку зв’язок між параметрами цих систем координат визначається з рис. 1.12.
Співвідношення, які пов’язують координати x,y,z декартової прямокутної системи координат із сферичними координатами r, , такі:
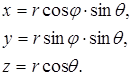 (3)
(3)
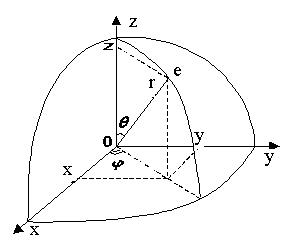
Рис. 1.
Таким чином можна вважати, що хвильова функція електрона в атомі водню залежить від сферичних координат, тобто r , .
Опустивши досить громіздкі перетворення переходу від декартової системи координат до сферичної, одержимо:
![]() . (4)
. (4)
Якщо розглядати основний (не збуджений) стан атома водню, то другою й третьою складовими в лівій частині рівняння (4) можна знехтувати. Електрон в такому стані рухається лише по коловій траєкторії і хвильова функція не залежить від і . Тому
 . (5)
. (5)
Хвильова функція електрона в основному стані (5) є функцією лише r , тобто r ). Такий стан називається s-станом; він має сферично-симетричний характер. Імовірність виявити електрон у заданій точці атома залежатиме лише від r . Умовам стаціонарного стану відповідає центральносиметрична функція, що легко диференціюється і має вигляд:
 , (6)
, (6)
де a ─ деяка стала величина, яка має розмірність довжини.
Необхідні похідні від (6) підставимо в (5). Після скорочення на ![]() одержимо:
одержимо:
--> ЧИТАТЬ ПОЛНОСТЬЮ <--