Реферат: Геометрія молекул
d = rост (А) + rост (В) + 2re ,
де re – радіус зв’язуючої електронної пари між двома атомами, rост – радіус атома без електронів.
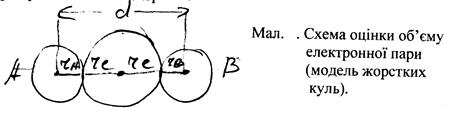
У випадку гомоядерної молекули віддаль між атомами може бути записана як: d = 2rков , тоді rков для атома: rков = rост + re . За цією формулою можна розрахувати радіуси електронних зв’язуючих для більшості елементів, користуючись ковалентними радіусами, які відповідають розмірам атомних "остовів": re = rков – rост . Знаючи розміри атомного остову і радіус електронної пари, можна розрахувати число електронних пар, які можуть розміститись навколо атомного остова. Це – координаційне число електронної оболонки: к. ч. = ![]() . Координаційне число показує скільки зв’язуючих електронних пар можна розмістити на валентній електронній оболонці даного атома.
. Координаційне число показує скільки зв’язуючих електронних пар можна розмістити на валентній електронній оболонці даного атома.
В молекулах поряд із зв’язуючими електронними парами є і неподільні. Неподільна електронна пара перебуває під впливом тільки одного атомного остова, тому її об’єм більший, ніж у зв’язуючого, що знаходиться в полі двох атомних остовів. Наближену оцінку розміру неподільної електронної пари можна одержати з іонних радіусів: re (неподіл) = rіон – rостова .
Розрахунки показують, що радіуси неподільних електронних пар більші, ніж зв’язуючих. Внаслідок цього спостерігається зменшення координаційного числа атомної оболонки. Більший розмір неподільної електронної пари і її більш симетричне розміщення по відношенню до центрального остова приводить до зменшення валентних кутів між зв’язуючими електронними парами.
Неподільна електронна пара займає більше місця навколо центрального остова ніж зв’язуюча, тому вона відштовхує інші електронні пари енергійніше. Найбільшу взаємодію слід чекати між двома неподільними парами. Відштовхування між електронними парами зменшується в такому порядку: (Н–Н) > (H–З) > (З–З), де Н – неподільна електронна пара; З – зв’язуюча електронна пара. Якщо на валентній оболонці атома можливі альтернативні положення одної або декількох електронних пар, то вони намагаються зайняти такі положення, де взаємодія між ними буде мінімальною. Слід чекати також, що розмір з’єднуючих електронних пар залежатиме також від електронегативності лігандів, що приймають участь в хімічному зв’язку. Чим більша електронегативність ліганду тим менший радіус зв’язуючої електронної пари.
Координаційне число визначає геометричну конфігурацію молекул. Атом, який містить n електронів на валентній оболонці, утворює n або 8 – n ковалентних зв’язків. Прагнення атома до побудови стабільної зовнішньої оболонки з 8 електронів трактується як правило октета.
Електронні пари, як було показано вище, поділяються на зв’язуючі, якщо вони локалізовані між двома ядрами, і незв’язуючі, або неподілені, якщо вони належать одному ядру. Отже, геометрична будова молекули визначається просторовим напрямком ковалентних зв’язків атомів, який обумовлюється числом зв’язуючих і неподілених електронних пар на валентній оболонці. Якщо кожну електронну пару представити у вигляді точки, то будову молекули можна зобразити у вигляді багатогранника, який одержиться при з’єднанні всіх точок прямими лініями. Можливі конфігурації молекул в залежності від координаційних зв’язуючих електронних пар, числа валентної оболонки та типу гібридизації атомних орбіталей приведені в таблиці .
Таблиця Комбінація електронів зв’язку і форма молекул
|
Число зв’язків |
Електрони зв’язку (типи гібридизації) |
Форма молекули |
|
2 |
sp, dp |
лінійна |
|
p2 , ds, d2 |
кутова | |
|
3 |
sp2 , dp2 , d2 s1 , d3 |
трикутна |
|
p3 , d2 p1 |
тригональна піраміда | |
|
4 |
sp3 , sd3 |
тетраедр |
|
d2 sp, dp3 , d3 p |
спотворений тетраедр | |
|
dsp2 , d2 p2 |
К-во Просмотров: 546
Бесплатно скачать Реферат: Геометрія молекул
|